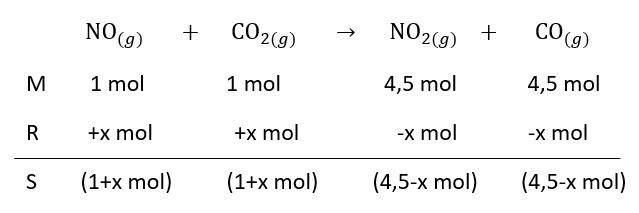Iklan
Pertanyaan
Pada suhu dan tekanan tertentu dalam wadah 5 L terdapat kesetimbangan NO ( g ) + CO 2 ( aq ) ⇌ NO 2 ( a q ) + CO ( a q ) Konsentrasi gas NO dan CO 2 pada keadaan kesetimbangan masing-masing adalah 0,2 M, sedangkan konsentrasi gas NO 2 dan CO masing-masing adalah 0,4 M. Bila ke dalam wadah tersebut ditambahkan gas NO 2 dan CO masing-masing sebanyak 2,5 mol maka konsentrasi gas NO dalam kesetimbangan yang baru adalah ....
Pada suhu dan tekanan tertentu dalam wadah 5 L terdapat kesetimbangan
Konsentrasi gas dan pada keadaan kesetimbangan masing-masing adalah 0,2 M, sedangkan konsentrasi gas dan masing-masing adalah 0,4 M. Bila ke dalam wadah tersebut ditambahkan gas dan masing-masing sebanyak 2,5 mol maka konsentrasi gas dalam kesetimbangan yang baru adalah ....
0,17 M
0,25 M
0,37 M
0,45 M
0,60 M
Iklan
SL
S. Lubis
Master Teacher
Jawaban terverifikasi
1
0.0 (0 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia