Menurut Arhennius Asam merupakan senyawa yang jika dilarutkan di air akan melepaskan  dan Basa adalah senyawa yang jika dilarutkan di air akan melepaskan
dan Basa adalah senyawa yang jika dilarutkan di air akan melepaskan  .
.
Asam yang jika dilarutkan dalam air banyak melepaskan  dinamakan asam kuat sedangkan yang melepas sedikit
dinamakan asam kuat sedangkan yang melepas sedikit  disebut asam lemah, sehingga pH asam kuat lebih kecil (lebih asam) daripada asam lemah.
disebut asam lemah, sehingga pH asam kuat lebih kecil (lebih asam) daripada asam lemah.
Kekuatan asam ditentukan oleh derajat ionisasinya. Asam kuat adalah senyawa asam yang derajat ionisasinya adalah 1 artinya semua ion akan terionisasi/ terurai dalam air. Sedangkan asam lemah adalah senyawa yang derajat ionisasinya kurang dari 1 atau tidak semua ion dalam senyawa terurai saat dilarutkan dalam air sehingga memiliki nilai tetapain ionisasi asam (Ka).
Senyawa elektrolit kuat merupakan asam kuat dan elektrolit lemah merupakan asam lemah. Senyawa asam organik termasuk dalam asam lemah, asam organik biasanya adalah suatu asam karboksilat.
Adapun contoh senyawa-senyawa yang termasuk asam kuat dan lemah yaitu:
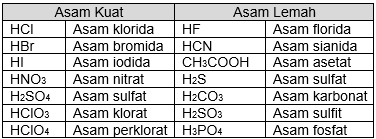
Jika terdapat senyawa yang sama-sama kuat atau sama-sama lemah maka kita perlu menguraikan ionnya agar mengetahui jumlah  yang dilepaskan.
yang dilepaskan.
Maka kita dapat menganalisa pilihan jawaban sebagai berikut:
 merupakan asam lemah (asam organik yaitu asam benzoat) yang melepaskan 1
merupakan asam lemah (asam organik yaitu asam benzoat) yang melepaskan 1 
 merupakan asam lemah (asam organik asam etanoat atau asam asetat) yang melepaskan 1
merupakan asam lemah (asam organik asam etanoat atau asam asetat) yang melepaskan 1 
 merupakan asam kuat yang melepaskan 2
merupakan asam kuat yang melepaskan 2 
 merupakan asam lemah yang melepaskan 2
merupakan asam lemah yang melepaskan 2 
 merupakan asam kuat yang melepaskan 1
merupakan asam kuat yang melepaskan 1 
Diantara asam lemah  dan
dan  yang keasamannya lebih kuat adalah
yang keasamannya lebih kuat adalah  . Ion benzoat
. Ion benzoat  pada asam benzoat merupakan ion yang stabil karena adanya cincin benzena yang mendorong resonansi (pergeseran atau pergerakan elektron bebas) lebih kuat daripada gugus -
pada asam benzoat merupakan ion yang stabil karena adanya cincin benzena yang mendorong resonansi (pergeseran atau pergerakan elektron bebas) lebih kuat daripada gugus - pada asam asetat.
pada asam asetat.
Resonansi pergerakan elektron pada ion benzoat
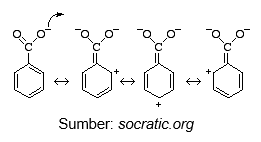
Pergerakan elektron karena resonansi terutama disekitar atom oksigen akan melemahkan ikatan O-H pada senyawa  . Karena ikatan O-H lemah maka atom H akan mudah lepas atau terionisasi menjadi
. Karena ikatan O-H lemah maka atom H akan mudah lepas atau terionisasi menjadi  . Hal tersebut lah yang meningkatkan keasaman pada
. Hal tersebut lah yang meningkatkan keasaman pada  .
.
Jadi diantara asam asetat dan asam benzoat yang pH nya lebih tinggi atau lebih tidak asam adalah  , maka pilihan jawaban yang benar adalah B
, maka pilihan jawaban yang benar adalah B


















