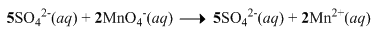Iklan
Pertanyaan
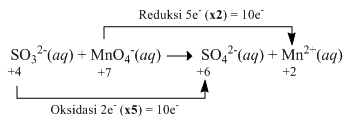
Oksidasi ion sulfit ( SO 3 2 − ) dapat dilakukan denganmenggunakan ion permanganat ( MnO 4 − ) menurutreaksi berikut: 6 H + ( a q ) + 5 SO 3 2 − ( a q ) + 2 MnO 4 − ( a q ) → 5 SO 4 2 − ( a q ) + 2 Mn 2 + ( a q ) + 3 H 2 O ( l ) Dalam suatu reaksi digunakan 100 mL larutan H 2 SO 3 0,10 M dan 100 mL larutan KMnO 4 yang didapat daripengenceran 5 mL larutan KMnO 4 2,0 M. Dalam reaksi redoks setara, jumlah elektron yang terlibat untuk setiap 5 mol SO 3 2 − adalah ....
Oksidasi ion sulfit () dapat dilakukan dengan menggunakan ion permanganat () menurut reaksi berikut:
Dalam suatu reaksi digunakan 100 mL larutan 0,10 M dan 100 mL larutan yang didapat dari pengenceran 5 mL larutan 2,0 M.
Dalam reaksi redoks setara, jumlah elektron yang terlibat untuk setiap 5 mol adalah ....
2 mol
5 mol
7 mol
10 mol
14 mol
Iklan
SL
S. Lubis
Master Teacher
Jawaban terverifikasi
18
5.0 (3 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia