Iklan
Pertanyaan
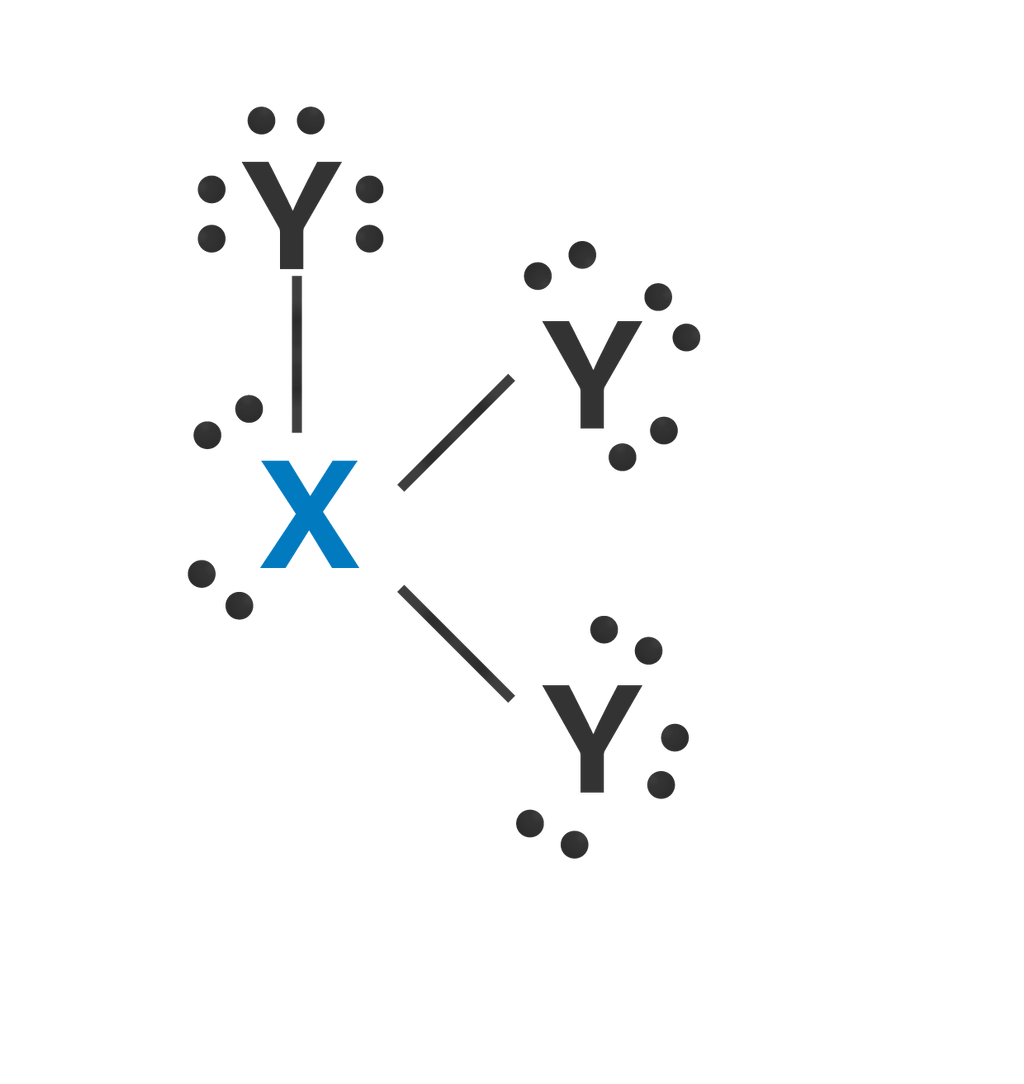
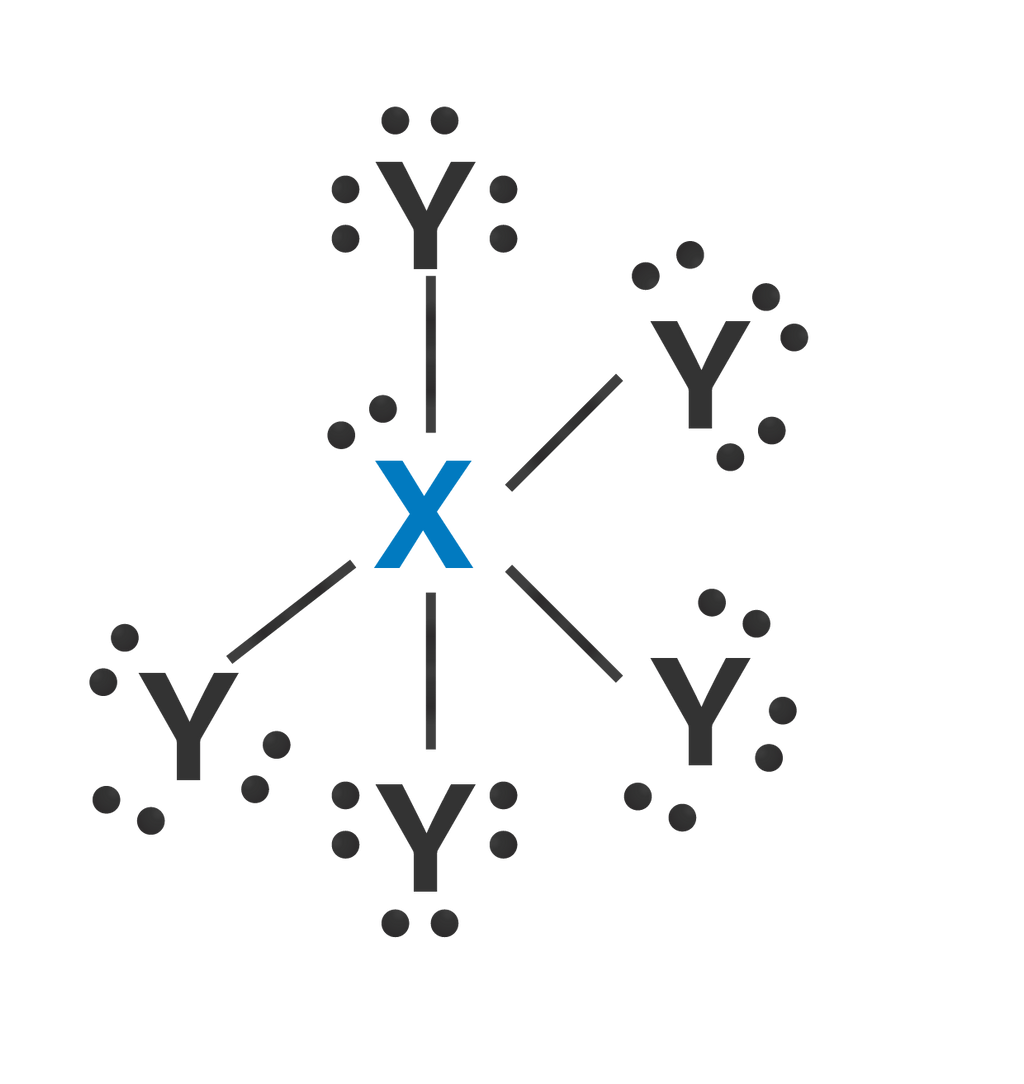
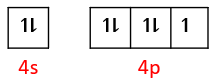
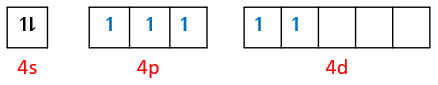
Molekul XY 3 dan XY 5 dibentuk dari atom X dengan nomor atom 35 dan atom Y dengan nomor atom 9. Pernyataan yang benar tentang kedua molekul tersebut adalah ... hibridisasi kedua molekul adalah sp 3 d 2 bentuk molekul XY 3 adalah piramida segi empat, sedangkan XY 5 adalah planar bentuk T jumlah PEB atom X pada XY 3 dan XY 5 secara berurutan adalah 1 dan 0 kedua molekul bersifat polar
Molekul dan dibentuk dari atom X dengan nomor atom 35 dan atom Y dengan nomor atom 9. Pernyataan yang benar tentang kedua molekul tersebut adalah ...
- hibridisasi kedua molekul adalah
- bentuk molekul adalah piramida segi empat, sedangkan adalah planar bentuk T
- jumlah PEB atom X pada dan secara berurutan adalah 1 dan 0
- kedua molekul bersifat polar
1, 2, dan 3 SAJA yang benar.
1 dan 3 SAJA yang benar.
2 dan 4 SAJA yang benar.
HANYA 4 yang benar.
SEMUA pilihan benar.
Iklan
IS
I. Solichah
Master Teacher
Jawaban terverifikasi
2
0.0 (0 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia