Iklan
Pertanyaan
Menurut skala Pauling keelektonegatifan beberapa unsur alkali dan alkali tanah diberikan pada tabel berikut. Berdasarkan data tersebut, tentukan ikatan ion yang dapat terjadi dan tidak dapat terjadi pada senyawa LiCl , NaCl , KCl , BeCl 2 , dan SrCl 2 !
Menurut skala Pauling keelektonegatifan beberapa unsur alkali dan alkali tanah diberikan pada tabel berikut.
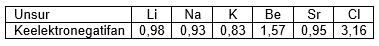
Berdasarkan data tersebut, tentukan ikatan ion yang dapat terjadi dan tidak dapat terjadi pada senyawa , , , , dan !
Iklan
IS
I. Solichah
Master Teacher
Jawaban terverifikasi
1
4.8 (8 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia















