Iklan
Pertanyaan
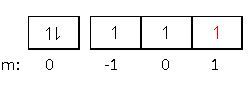
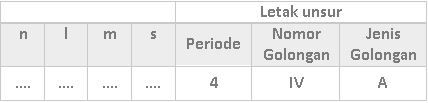
Lengkapilah tabel berikut untuk mengetahui letak unsur pada tabel periodik unsur dengan keempat jenis bilangan kuantum elektron terakhirnya!
Lengkapilah tabel berikut untuk mengetahui letak unsur pada tabel periodik unsur dengan keempat jenis bilangan kuantum elektron terakhirnya!
Iklan
Q'
Q. 'Ainillana
Master Teacher
Mahasiswa/Alumni Universitas Negeri Yogyakarta
Jawaban terverifikasi
1
3.0 (1 rating)
bp
bunga putri
Pembahasan terpotong Makasih ❤️
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia