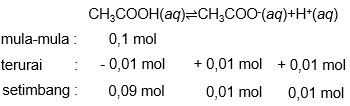Iklan
Pertanyaan
Larutan asam asetat ( CH 3 COOH ) 0,1 M terurai membentuk reaksi kesetimbangan: CH 3 COOH ( a q ) ⇌ CH 3 COO − ( a q ) + H + ( a q ) dengan derajat disosiasi α = 0 , 1 .Hitunglah konsentrasi ion H + di dalam larutan!
Larutan asam asetat () 0,1 M terurai membentuk reaksi kesetimbangan:
dengan derajat disosiasi . Hitunglah konsentrasi ion di dalam larutan!
Iklan
YR
Y. Rochmawatie
Master Teacher
Jawaban terverifikasi
152
4.8 (24 rating)
RD
Rosida Dewi
Mudah dimengerti
HA
Hikmah, A
Pembahasan lengkap banget Ini yang aku cari! Bantu banget Makasih ❤️ Mudah dimengerti
f
feltalive
Bantu banget. Makasih ❤️
LM
Lorenza Meilani
Makasih ❤️
je
jauzaa end
Mudah dimengerti Bantu banget Makasih ❤️
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia