Iklan
Pertanyaan
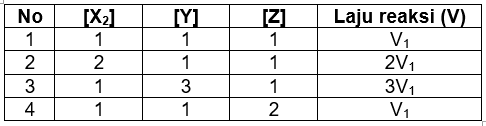
Laju reaksi merupakan perubahan konsentrasi reaktan atau produk terhadap waktu (M/s). Persamaan kimia yang sudah sepenuhnya setara tidak memberi informasi banyak tentang bagaimana reaksi sepenuhnya terjadi. Dalam banyak kasus, persamaan ini sekedar menyatakan jumlah dari sederet reaksi sederhana yang sering dinamakan tahap elementer karena reaksi-reaksi sederhana tersebut merepresentasikan jalannya reaksi keseluruhan pada tingkat molekul. Urutan tahap-tahap elementer yang mengarah pada pembentukan produk dinamakan mekanisme reaksi. Untuk reaksi X 2 + Y + Z → XY + XZ diketahui bahwa dengan melipatduakan konsentrasi X 2 akan melipatduakan laju reaksi. Sedangkan dengan melipattigakan konsentrasi Y akan melipattigakan laju reaksi, dan dengan melipatduakan konsentrasi Z tidak berpengaruh terhadap laju reaksi. Hukum laju reaksi persamaan di atas adalah ...
Laju reaksi merupakan perubahan konsentrasi reaktan atau produk terhadap waktu (M/s). Persamaan kimia yang sudah sepenuhnya setara tidak memberi informasi banyak tentang bagaimana reaksi sepenuhnya terjadi. Dalam banyak kasus, persamaan ini sekedar menyatakan jumlah dari sederet reaksi sederhana yang sering dinamakan tahap elementer karena reaksi-reaksi sederhana tersebut merepresentasikan jalannya reaksi keseluruhan pada tingkat molekul. Urutan tahap-tahap elementer yang mengarah pada pembentukan produk dinamakan mekanisme reaksi. Untuk reaksi diketahui bahwa dengan melipatduakan konsentrasi akan melipatduakan laju reaksi. Sedangkan dengan melipattigakan konsentrasi Y akan melipattigakan laju reaksi, dan dengan melipatduakan konsentrasi Z tidak berpengaruh terhadap laju reaksi.
Hukum laju reaksi persamaan di atas adalah ...
Iklan
Q. 'Ainillana
Master Teacher
Mahasiswa/Alumni Universitas Negeri Yogyakarta
1
5.0 (1 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia