Ketika atom berinteraksi untuk membentuk ikatan kimia, hanya bagian terluarnya yang bersinggungan dengan atom lain. Oleh karena itu, untuk mempelajari ikatan kimia kita hanya perlu membahas elektron valensi dari atom-atom yang terlibat. Sistem titik yang disusun oleh Lewis digunakan untuk menggambarkan elektron valensi dari atom-atom yang terlibat dalam pembentukan ikatan kimia.
Sistem tersebut juga digunakan untuk meyakinkan bahwa atom-atom yang terlibat tidak mengalami perubahan. Lambang titik lewis (Lewis dot symbol) terdiri dari lambang unsur dan titik-titik yang setiap titiknya menggambarkan setiap elektron valensi dari atom-atom unsur.
Untuk mengatahui ikatan yang terjadi pada senyawa CCl4 kita perlu menentukan elektron valensi dari masing-masing atom
6C=2 4 (elektron valensi 4)17Cl=2 8 7 (elektron valensi 7)
Sehingga kita bisa gambarkan ikatan kedua atom dalam senyawa CCl4 seperti berikut:
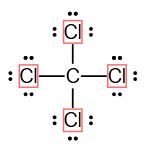
Satu garis menandakan ikatan rangkap 1 yang terbentuk dari pasangan elektron atom Cl dan atom C. Pembentukan ikatan rangkap 1 antara atom Cl dan C terjadi karena pemakaian bersama pasangan elektron tersebut, atau kita sebut sebagai ikatan kovalen rangkap 1.
Ikatan kovalen yang terbentuk antara atom C dengan atom Cl memiliki perbedaan keelektronegatifan sebesar 0,4. Berarti, ikatan kovalen ini bersifat polar. Namun, jika atom C mengikat empat buah atom Cl dan membentuk molekul CCl4, molekulnya bersifat nonpolar.
Pada molekul CCl4, atom pusat C berada di tengah dan secara simetris mengikat keempat atom Cl. Hal tersebut menyebabkan tidak ada pemisahan muatan sehingga dipol tidak terbentuk. Jadi, walaupun ikatannya bersifat polar, molekulnya bersifat nonpolar.
Jadi, senyawa CCl4 memiliki ikatan kovalen non polar
















