Iklan
Pertanyaan
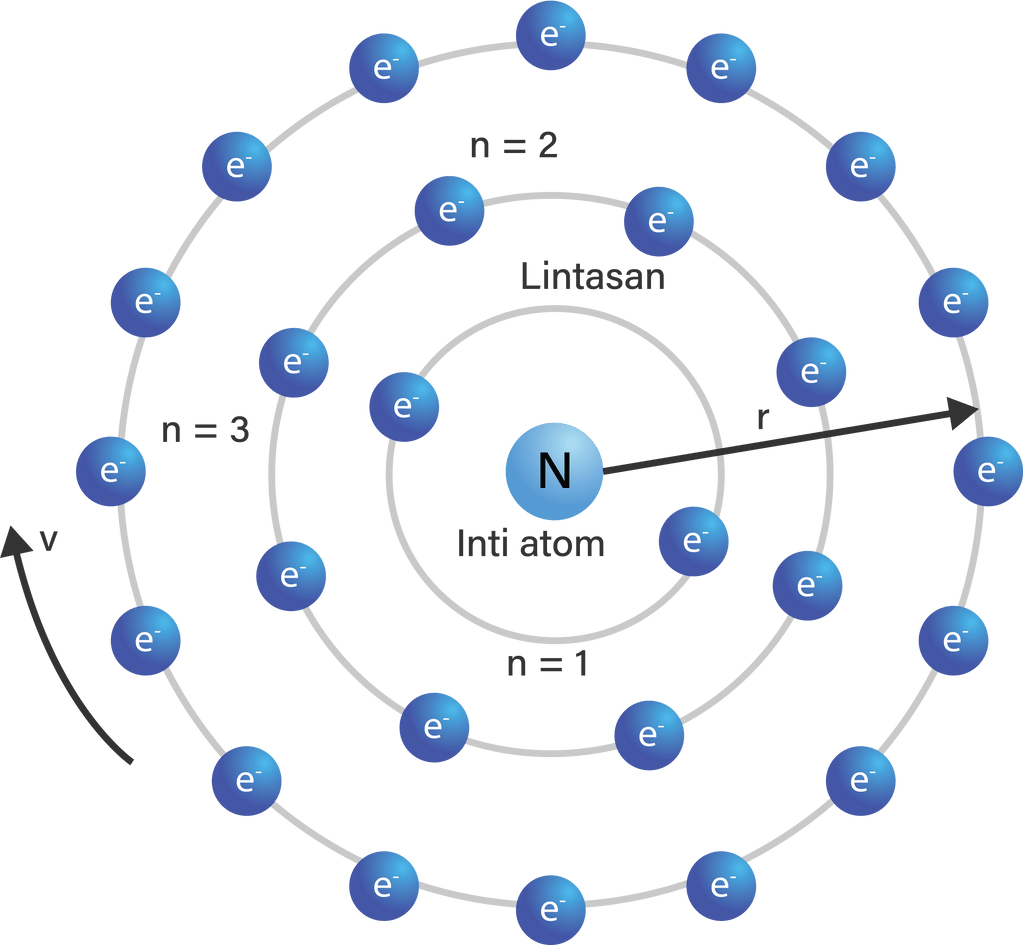
Jelaskan bagaimana kira-kira model atom Bohr bisa menjelaskan peristiwa terjadinya spektrum atom hidrogen!
Jelaskan bagaimana kira-kira model atom Bohr bisa menjelaskan peristiwa terjadinya spektrum atom hidrogen!
Iklan
Q'
Q. 'Ainillana
Master Teacher
Mahasiswa/Alumni Universitas Negeri Yogyakarta
Jawaban terverifikasi
8
4.4 (7 rating)
SA
Silva Adwiyani
Ini yang aku cari!
A
Aldebaran
Bantu banget
CH
Cherli Handayani
Pembahasan lengkap banget
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia