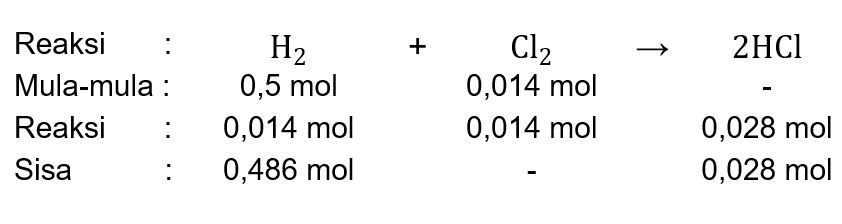Iklan
Pertanyaan
Gas hidrogen direaksikan dengan gas khlor menurut persamaan reaksi H 2 ( g ) + Cl 2 ( g ) → HCl ( g ) Jika tekanan dan temperatur tetap, maka reaksi ini menyatakan.... 1 molekul gas hidrogen bereaksi dengan 1 molekul gas khlor menghasilkan 2 molekul gas hidrogen khlorida 1 liter gas hidrogen bereaksi dengan 1 liter gas khlor menghasilkan 2 liter gas hidrogen khlorida 1 gram gas hidrogen bereaksi dengan 1 gram gas khlor menghasilkan 2 gram gas hidrogen khlorida 1 mol hidrogen bereaksi dengan 1 mol gas khlor menghasilkan 2 mol gas hidrogen khlorida
Gas hidrogen direaksikan dengan gas khlor menurut persamaan reaksi
Jika tekanan dan temperatur tetap, maka reaksi ini menyatakan....
- 1 molekul gas hidrogen bereaksi dengan 1 molekul gas khlor menghasilkan 2 molekul gas hidrogen khlorida
- 1 liter gas hidrogen bereaksi dengan 1 liter gas khlor menghasilkan 2 liter gas hidrogen khlorida
- 1 gram gas hidrogen bereaksi dengan 1 gram gas khlor menghasilkan 2 gram gas hidrogen khlorida
- 1 mol hidrogen bereaksi dengan 1 mol gas khlor menghasilkan 2 mol gas hidrogen khlorida
Iklan
RU
R. Ulfi
Master Teacher
Mahasiswa/Alumni Universitas Negeri Yogyakarta
Jawaban terverifikasi
5
1.0 (1 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia