Iklan
Pertanyaan
Diketahui sistem larutan sebagai berikut berdasarkan data, pernyataan yang sesuai adalah...
Diketahui sistem larutan sebagai berikut berdasarkan data, pernyataan yang sesuai adalah...
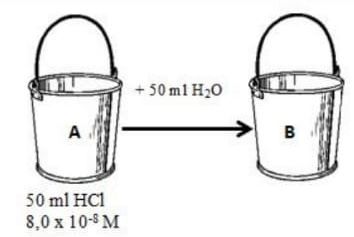
Harga pH larutan di ember B adalah 7-log 1,35
Harga pH larutan HCl akan semakin basa seiring penambahan
Harga pH larutan di ember A adalah 9-log 1,35
Tingkat kesaman di ember A empat kali lebih asam daripada larutan di ember B
Iklan
AA
A. Acfreelance
Master Teacher
Jawaban terverifikasi
1
5.0 (1 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia















