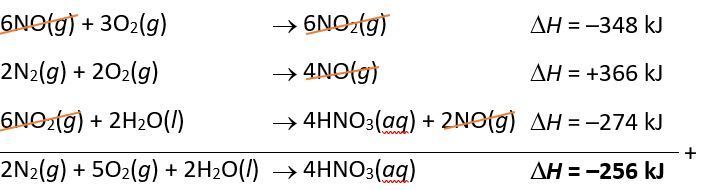Iklan
Pertanyaan
Diketahui reaksi-reaksi sebagai berikut. 2 NO ( g ) + O 2 ( g ) → 2 NO 2 ( g ) △ H = − 116 kJ N 2 ( g ) + O 2 ( g ) → 2 NO ( g ) △ H = + 183 kJ 3 NO 2 ( g ) + H 2 O ( l ) → 2 HNO 3 ( a q ) + NO ( g ) △ H = − 137 kJ Tentukan pembakaran entalpi reaksi 2 N 2 ( g ) + 5 O 2 ( g ) + 2 H 2 O ( l ) → 4 HNO 3 ( a q ) !
Diketahui reaksi-reaksi sebagai berikut.
Tentukan pembakaran entalpi reaksi !
Iklan
NP
N. Puspita
Master Teacher
Jawaban terverifikasi
2
3.8 (7 rating)
MR
Muhammad Rizki
Bantu banget
TH
Tohid Hidayah
Jawaban nya mudah dimengerti
A
Anon
Jawaban tidak sesuai. kak
BA
Brillian Arya Desta Putra Wicaksono
Jawaban tidak sesuai
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia