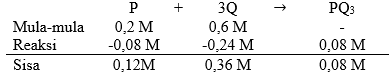Iklan
Pertanyaan
Diketahui reaksi: P + 3 Q → PQ 3 Dari hasil percobaan akhirnya dapat ditentukan rumus laju reaksi v = k [ P ] 1 [ Q ] 2 Mula-mula direaksikan 0,2 M zat P dan 0,6 M zat Q serta harga k = 0 , 01 mol − 2 L 2 det − 1 Berapakah harga laju reaksi pada saat P telah bereaksi sebesar 40% ....
Diketahui reaksi:
Dari hasil percobaan akhirnya dapat ditentukan rumus laju reaksi
Mula-mula direaksikan 0,2 M zat P dan 0,6 M zat Q serta harga
Berapakah harga laju reaksi pada saat P telah bereaksi sebesar 40% ....
Iklan
NP
N. Puspita
Master Teacher
Jawaban terverifikasi
4
4.0 (9 rating)
a
alika
Mudah dimengerti
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia