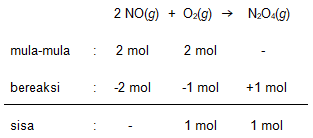Iklan
Pertanyaan
Diketahui reaksi 2 NO ( g ) + O 2 ( g ) → N 2 O 4 ( g ) . Bila mula-mula 2 mol NO bereaksi dengan 2 mol oksigen dalam ruang 2 liter selama 10 detik, tentukan besarnya laju reaksi pembentukan N 2 O 4 !
Diketahui reaksi .
Bila mula-mula 2 mol bereaksi dengan 2 mol oksigen dalam ruang 2 liter selama 10 detik, tentukan besarnya laju reaksi pembentukan !
Iklan
SS
S. Susanti
Master Teacher
Mahasiswa/Alumni Universitas Jayabaya
Jawaban terverifikasi
52
4.1 (7 rating)
TR
Triannisa Ramadhani
Pembahasan lengkap banget Makasih ❤️
DP
Dika Prima
Jawaban tidak sesuai
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia