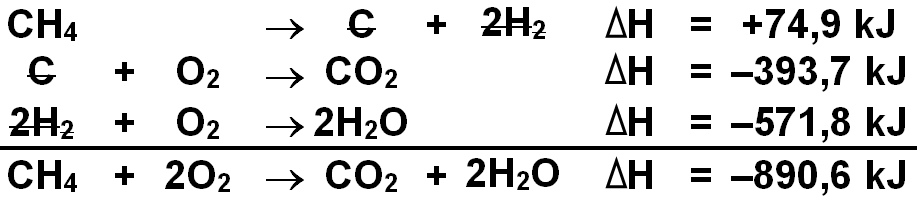Iklan
Pertanyaan
Diketahui: C ( s ) + 2 H 2 ( g ) C ( s ) + O 2 ( g ) H 2 ( g ) + 2 1 O 2 ( g ) → → → CH 4 ( g ) △ H = − 74 , 9 kJ CO 2 ( g ) △ H = − 393 , 7 kJ H 2 O ( l ) △ H = − 285 , 9 kJ Perubahan entalpi untuk reaksi: CH 4 ( g ) + 2 O 2 ( g ) → CO 2 ( g ) + 2 H 2 O ( l ) adalah ... (UMPTN '90 Rayon B)
Diketahui:
Perubahan entalpi untuk reaksi:
adalah ...
(UMPTN '90 Rayon B)
-604,7 kJ
-890,6 kJ
-998,4 kJ
-1040,3 kJ
-1284,3 kJ
Iklan
BR
B. Rohmawati
Master Teacher
Mahasiswa/Alumni Universitas Negeri Semarang
Jawaban terverifikasi
5
4.3 (10 rating)
PN
Putri Natasya
Ini yang aku cari!
NB
NAURA BILLAH AFKARINA YOGADETYA
Ini yang aku cari! Makasih ❤️
SC
Sharfina Cahya Dewi
Ini yang aku cari! Bantu banget Makasih ❤️
DM
Deppiana Maygita laras
Soal aku gk ktemu
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia