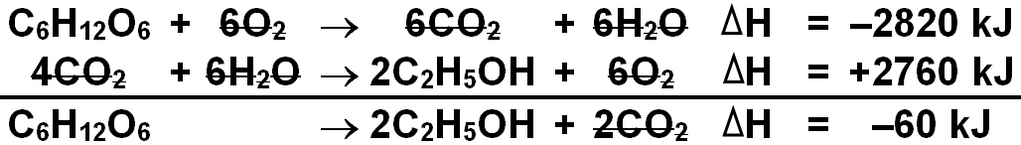Iklan
Pertanyaan
Diketahui: C 6 H 12 O 6 + 6 O 2 C 2 H 5 OH + 3 O 2 → → 6 CO 2 + 6 H 2 O △ H = − 2820 kJ 2 CO 2 + 3 H 2 O △ H = − 1380 kJ Perubahan entalpi bagi reaksi fermentasi glukosa: C 6 H 12 O 6 → 2 C 2 H 5 OH + 2 CO 2 adalah ... (UMPTN '90 Rayon 8)
Diketahui:
Perubahan entalpi bagi reaksi fermentasi glukosa:
adalah ...
(UMPTN '90 Rayon 8)
+60 kJ
-60 kJ
+1440 kJ
-1440 kJ
+2880 kJ
Iklan
BR
B. Rohmawati
Master Teacher
Mahasiswa/Alumni Universitas Negeri Semarang
Jawaban terverifikasi
13
4.6 (27 rating)
RO
Rara Oksindri
Pembahasan lengkap banget
AR
Ardilla Ramadhani
Pembahasan lengkap banget
AF
Adrian Fatikh
Pembahasan lengkap banget
i_
iLhaM _33
Makasih ❤️
MD
Marbun Do On Marbun
Pembahasan terpotong
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia