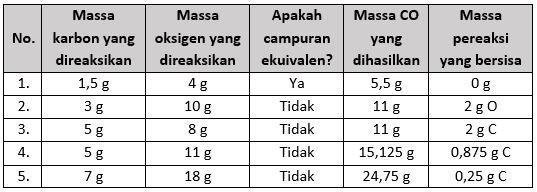
Berdasarkan hukum Proust, massa unsur-unsur penyusun suatu senyawa selalu sama dan berbanding sebagai bilangan bulat sederhana. Pada soal sudah diketahui perbandingan massa C dan O sebesar 3 : 8 sehingga dapat dihitung massa zat yang bersisa dan massa zat yang habis bereaksi (pereaksi pembatas). Untuk mengetahui mana yang tersisa, bagi massa unsur dengan nilai pembanding. Unsur dengan hasil yang lebih besar akan tersisa dan jika kedua hasilnya sama, berarti ekuivalen. Maka:
Nomor 1: m C = 1,5 g dan m O = 4 g
m C m O==31,5=0,584=0,5
Campuran tersebut ekuivalen karena sesuai perbandingan unsurnya. Selain itu, tidak ada massa pereaksi yang tersisa.
m CO terbentuk=1,5 g+4 g=5,5 g
Nomor 2: m C = 3 g dan m O = 10 g
m C m O==33=1810=1,25
Campuran tersebut tidak ekuivalen dan akan tersisa unsur O.
m O bereaksi=8×1=8 gm O sisa=10−8=2 gm CO terbentuk=3+8=11 g
Nomor 3: m C = 5 g dan m O = 8 g
m C m O==35=1,6788=1
Campuran tersebut tidak ekuivalen dan akan tersisa unsur C.
m C bereaksi=3×1=3 gm C sisa=5−3=2 gm CO terbentuk=3+8=11 g
Nomor 4: m C = 5 g dan m O = 11 g
m C m O==35=1,67811=1,375
Campuran tersebut tidak ekuivalen dan akan tersisa unsur C.
m C bereaksi=3×1,375=4,125 gm C sisa=5−4,125=0,875 gm CO terbentuk=4,125+11=15,125 g
Nomor 5: m C = 7 g dan m O = 18 g
m C m O==37=2,33818=2,25
Campuran tersebut tidak ekuivalen dan akan tersisa unsur C.
m C bereaksi=3×2,25=6,75 gm C sisa=7−6,75=0,25 gm CO terbentuk=6,75+18=24,75 g
Jadi, data lengkap tabel tersebut adalah: