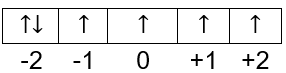Pada penentuan konfigurasi elektron, jumlah orbital yang terisi elektron dan yang tidak, serta penentuan keempat bilangan kuantum, diperlukan untuk mengetahui jumlah elektron dari atom tersebut.
a. konfigurasi elektron dari atom besi
jumlah elektron besi adalah sama dengan nomor atomnya yaitu 26, sehingga konfigurasi elektron besi adalah:
26Fe=1s22s22p63s23p64s23d6 atau penulisannya dapat disingkat dengan menggunakan gas mulia menjadi:
26Fe=[Ar]4s23d6
b. jumlah orbital yang terisi elektron
untuk menentukan jumlah orbital yang terisi elektron, dapat dengan menggunakan diagram orbital.
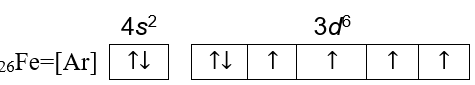
Ar memiliki 18 elektron= 9 orbital terisi penuh, subkulit 4s memiliki 1 orbital terisi penuh, dan subkulit 3d memiliki 1 orbital terisi penuh dan 4 orbital yang tidak terisi penuh. Sehingga jumlah orbital yang terisi elektron adalah 15 orbital dengan 11 orbital terisi penuh dan 4 orbital tidak.
c. jumlah orbital yang terisi elektron tidak berpasangan
Berdasarkan gambar diagram orbital, jumlah orbital yang terisi elektron tidak berpasangan adalah 4 orbital pada subkulit 3d.
d. keempat bilangan kuantum dari elektron terakhir
Bilangan kuantum adalah bilangan yang digunakan sebagai penentu kedudukan elektron dalam atom, terdapat 4 jenis bilangan kuantum yaitu bilangan kuantum utama, azimuth, magnetik, dan spin.
Elektron terakhir 26Fe adalah 3d6, maka
bilangan kuantum utamanya adalah 3,
bilangan kuantum azimuthnya adalah 2 (karena terletak pada subkulit d)
bilangan kuantum magnetik dan spinnya berdasarkan pada diagram orbital elektron terakhirnya:
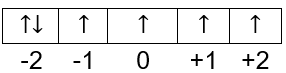
Elektron terakhir ada pada orbital -2 dan mengarah ke bawah maka nilai spinnya −21.
Jadi, konfigurasi elektron 26Fe adalah 26Fe=1s22s22p63s23p64s23d6 atau penulisannya dapat disingkat menggunakan unsur gas mulia 26Fe=[Ar]4s23d6 dengan 15 orbital terisi elektron (11 terisi penuh dan 4 terisi elektron tidak berpasangan), dan bilangan kuantum utama 26Fe adalah 3, bilangan kuantum azimuthnya adalah 2, bilangan kuantum magnetiknya adalah -2 dan bilangan kuantum spinnya adalah −21.