Iklan
Pertanyaan
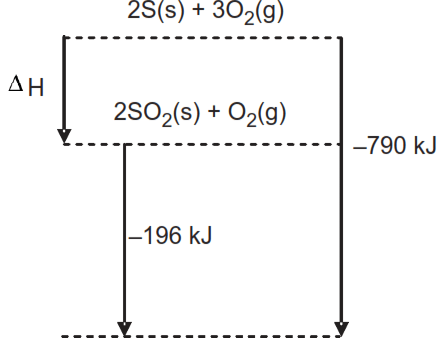
Diagram entalpi tahap-tahap reaksi sebagai berikut. Dari diagram perubahan entalpi di atas, maka △ H f untuk reaksi: S ( s ) + O 2 ( g ) → SO 2 ( g ) adalah ....
Diagram entalpi tahap-tahap reaksi sebagai berikut.
Dari diagram perubahan entalpi di atas, maka untuk reaksi:
adalah ....
Iklan
BR
B. Rohmawati
Master Teacher
Mahasiswa/Alumni Universitas Negeri Semarang
Jawaban terverifikasi
19
3.6 (6 rating)
RM
Ryouka Mizumi — 『リョウ・水見』
engga ngerti
DN
Dhiyaulaulia Nabila
Jawaban tidak sesuai
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia