Iklan
Pertanyaan
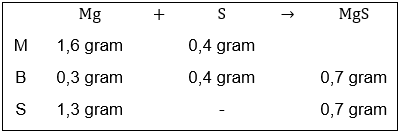
Di dalam senyawa MgS , perbandingan massa Mg : S = 3 : 4 Berapa gram massa logam magnesium dan belerang yang harus direaksikan agar diperoleh sebesar 4 gram? Jika direaksikan 1,6 gram logam Mg dan 0,4 gram belerang, tentukan massa yang dihasilkan. Jika ada zat yang tersisa, berapa massanya?
Di dalam senyawa , perbandingan massa Mg : S = 3 : 4
- Berapa gram massa logam magnesium dan belerang yang harus direaksikan agar diperoleh
sebesar 4 gram?
- Jika direaksikan 1,6 gram logam Mg dan 0,4 gram belerang, tentukan massa
yang dihasilkan. Jika ada zat yang tersisa, berapa massanya?
Iklan
FF
F. Faiz
Master Teacher
Jawaban terverifikasi
1
0.0 (0 rating)
Iklan
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia