Iklan
Pertanyaan
Dengan mengacu pada hukum Proust, diperoleh data reaksi antara tembaga dengan belerang yang menghasilkan tembaga(ll) sulfida seperti pada tabel berikut. Lengkapi data pada tabel di atas. Hitung perbandingan massa tembaga dan massa belerang dalam senyawa tembaga(II) sulfida.
Dengan mengacu pada hukum Proust, diperoleh data reaksi antara tembaga dengan belerang yang menghasilkan tembaga(ll) sulfida seperti pada tabel berikut.
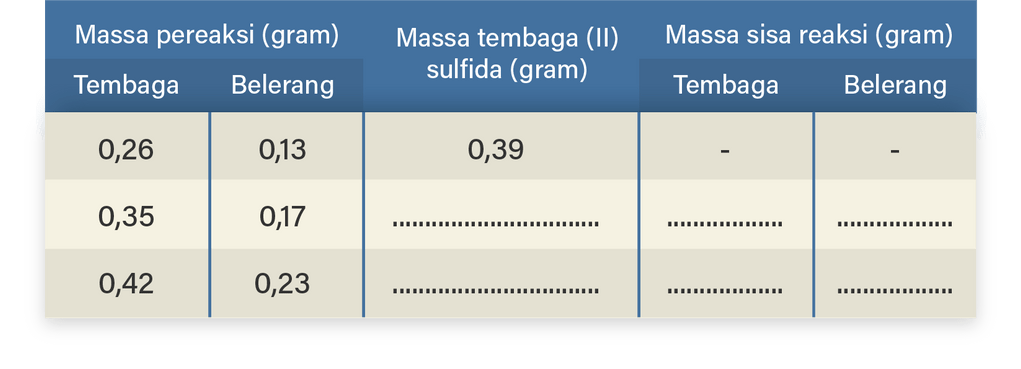
- Lengkapi data pada tabel di atas.
- Hitung perbandingan massa tembaga dan massa belerang dalam senyawa tembaga(II) sulfida.
Iklan
EB
E. Bintang
Master Teacher
Mahasiswa/Alumni Universitas Negeri Yogyakarta
Jawaban terverifikasi
2
3.6 (3 rating)
NS
Niluh Sayu
Makasih ❤️
EF
Elsi Febrianti
Jawaban tidak sesuai
Iklan
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia
















