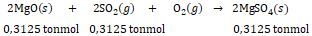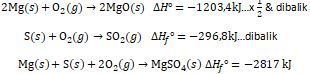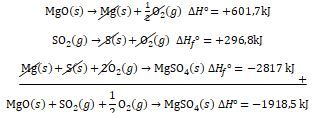Iklan
Pertanyaan
Data pada suhu 298,15 K, 1 atm: 2 Mg ( s ) + O 2 ( g ) → 2 MgO ( s ) △ H ∘ = − 1203 , 4 kJ ( 1 ) S ( s ) + O 2 ( g ) → SO 2 ( g ) △ H f ∘ = − 296 , 8 kJ ( 2 ) 2 SO 2 ( g ) + O 2 ( g ) → 2 SO 3 ( g ) △ H ∘ = − 197 , 8 kJ ( 3 ) SO 3 ( g ) + H 2 O ( l ) → H 2 SO 4 ( l ) △ H ∘ = − 130 , 0 kJ ( 4 ) Berdasarkan data yang diberikan: Gas SO 2 (64 g/mol) dan SO 3 (80 g/mol) merupakan gas-gas pencemar udara yang menimbulkan hujan asam dan banyak dihasilkan dari pembakaran bahan bakar fosil seperti minyak bumi dan batu bara. Di pembangkit tenaga listrik dengan bahan bakar batu bara, gas hasil pembakaran diserap dengan mereaksikan gas tersebut dengan MgO (40 g/mol) sesuai reaksi sebagai berikut: 2 MgO ( s ) + 2 SO 2 ( g ) + O 2 ( g ) → 2 MgSO 4 ( s ) Bila dari pembakaran batu bara dihasilkan 20 ton gas setiap tahunnya, maka: c. Berapa banyak (ton) MgO paling sedikit yang harus disediakan setiap tahunnya untuk menghilangkan gas tersebut. d. Berapa banyak (ton) MgSO 4 yang dapat dihasilkan setiap tahunnya. Bila entalpi pembentukan ( △ H f ∘ ) padat adalah -2.817 kJ/mol: e. Berapa banyak panas yang dibebaskan atau yang diserap untuk pembentukan 1 mol dalam reaksi(5)? Bila pembangkit listrik tersebut dapat menghasilkan H 2 SO 4 sebanyak 750 ton Per hari sesuai reaksi (4), maka: f. Hitunglah jumlah panas yang dihasilkan oleh pembangkit listrik tersebut setiap harinya.
Data pada suhu 298,15 K, 1 atm:
Berdasarkan data yang diberikan:
Gas (64 g/mol) dan (80 g/mol) merupakan gas-gas pencemar udara yang menimbulkan hujan asam dan banyak dihasilkan dari pembakaran bahan bakar fosil seperti minyak bumi dan batu bara. Di pembangkit tenaga listrik dengan bahan bakar batu bara, gas hasil pembakaran diserap dengan mereaksikan gas tersebut dengan MgO (40 g/mol) sesuai reaksi sebagai berikut:
Bila dari pembakaran batu bara dihasilkan 20 ton gas setiap tahunnya, maka:
c. Berapa banyak (ton) MgO paling sedikit yang harus disediakan setiap tahunnya untuk menghilangkan gas tersebut.
d. Berapa banyak (ton) yang dapat dihasilkan setiap tahunnya.
Bila entalpi pembentukan padat adalah -2.817 kJ/mol:
e. Berapa banyak panas yang dibebaskan atau yang diserap untuk pembentukan 1 mol dalam reaksi(5)?
Bila pembangkit listrik tersebut dapat menghasilkan sebanyak 750 ton Per hari sesuai reaksi (4), maka:
f. Hitunglah jumlah panas yang dihasilkan oleh pembangkit listrik tersebut setiap harinya.
Iklan
I. Solichah
Master Teacher
1
0.0 (0 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia