Konfigurasi elektron stabil dirniliki oleh golongan gas mulia (VIII A). Setiap unsur selalu berusaha untuk memiliki konfigurasi elektron seperti konfigurasi elektron gas mulia (kaidah oktet). Kecenderungan suatu unsur untuk mencapai kestabilan dapat diketahui berdasarkan besar energi ionisasi dan afinitas elektron yang dimilikinya. Unsur yang memiliki energi ionisasi rendah mudah melepaskan elektron untuk mencapai kestabilan, sedangkan unsur yang memiliki afinitas elektron tinggi lebih mudah untuk menangkap elektron untuk stabil.
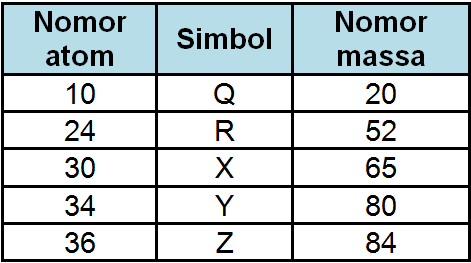
Untuk dapat menjawab soal di atas, maka terlebih dahulu perlu dibuat konfigurasi elektron dari unsur Q, R, X, Y, dan Z berdasarkan nomor atomnya. Konfigurasi elektron dari kelima unsur di atas adalah sebagai berikut.
10Q24R30X34Y36Z=====1s2 2s2 2p6[18Ar] 4s2 3d4[18Ar] 4s2 3d10[18Ar] 4s2 3d10 4p4[18Ar] 4s2 3d10 4p6
Berdasarkan konfigurasi elektron kelima unsur di atas, dapat ditentukan elektron valensinya, serta letak setiap unsur dalam sistem periodik unsur sebagai berikut.
- Elektron valensi unsur Q adalah 2s2 2p6, maka unsur Q memiliki 8 elektron valensi dan terletak pada golongan VIII A periode 2.

- Elektron valensi unsur R adalah 4s2 3d4, maka unsur R memiliki 6 elektron valensi dan terletak pada golongan VI B periode 4.

- Elektron valensi unsur X adalah 4s2 3d10, maka unsur X memiliki 12 elektron valensi dan terletak pada golongan II B periode 4.

- Elektron valensi unsur Y adalah 4s2 4p4, maka unsur Y memiliki 6 elektron valensi dan terletak pada golongan VI A periode 4.

- Elektron valensi unsur Z adalah 4s2 4p6, maka unsur Z memiliki 8 elektron valensi dan terletak pada golongan VIII A periode 4.

Atom fluor (nomor atom = 9) merupakan unsur yang terletak pada golongan VII A periode 2, maka unsur fluor (F) memiliki kecenderungan mengikat 1 elektron untuk mencapai kestabilan. Berdasarkan elektron valensi dan letak atom Q, R, X, Y, dan Z dalam sistem periodik unsur, maka unsur-unsur yang memiliki kecenderungan untuk berikatan dengan unsur fluor (F) adalah unsur R, X, dan Y. Hal ini disebabkan karena R, X, dan Y belum memenuhi kaidah oktet, sehingga masih memiliki kecenderungan membentuk ikatan kimia dengan ato F, baik secara ikatan ion maupun kovalen.
Unsur Q dan Z merupakan unsur dengan elektron valensi = 8 yang telah mencapai kestabilan menurut kaidah oktet karena memiliki konfigurasi gas mulia, tetapi unsur Z masih dapat membentuk ikatan kimia dengan unsur fluor. Unsur Q yang terletak pada golongan VIII A periode 2 merupakan unsur Ne, sedangkan unsur Z yang terletak pada golongan VIII A periode 4 merupakan unsur Kr.
Di alam, gas mulia selalu ditemukan dalam bentuk monoatomik (atom tunggal), namun para ahli telah berhasil mensintesis senyawa gas mulia Ar, Kr, Xe, dan Rn. Kereaktifan unsur meningkat dari Ar ke Rn, di mana dalam reaksi dengan fluorin (F2), Rn dapat bereaksi spontan, Xe memerlukan pemanasan atau penyinaran dengan sinar UV agar reaksi berlangsung, dan Kr hanya bereaksi jika diberi muatan listrik atau sinar X pada suhu yang sangat rendah. Unsur He dan Ne ditemukan tidak mengalami reaksi kimia dan membentuk senyawa. Oleh karena itu, unsur Z masih dapat membentuk senyawa dengan atom fluor (F) karena letaknya di periode ke-4 yang menyebabkan kereaktifannya lebih besar daripada atom Q yang berada pada periode ke-2.
Dengan demikian, maka atom yang tidak mungkin membentuk senyawa dengan atom fluor adalah atom Q.
Jadi, jawaban yang tepat adalah A.