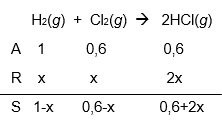Iklan
Pertanyaan
Dalam wadah tertutup bervolume 6 L berlangsung kesetimbangan antara 0,8 mol gas hidrogen, 0,6 mol gas klorin, dan 0,6 mol gas hidrogen klorida pada suhu dan tekanan tertentu. Jika pada suhu yang sama ke dalam sistem kesetimbangan tersebut ditambahkan 0,2 mol gas hidrogen, tentukan susunan kesetimbangan gas baru!
Dalam wadah tertutup bervolume 6 L berlangsung kesetimbangan antara 0,8 mol gas hidrogen, 0,6 mol gas klorin, dan 0,6 mol gas hidrogen klorida pada suhu dan tekanan tertentu. Jika pada suhu yang sama ke dalam sistem kesetimbangan tersebut ditambahkan 0,2 mol gas hidrogen, tentukan susunan kesetimbangan gas baru!
Iklan
IS
I. Solichah
Master Teacher
Jawaban terverifikasi
2
4.0 (2 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia