Iklan
Pertanyaan
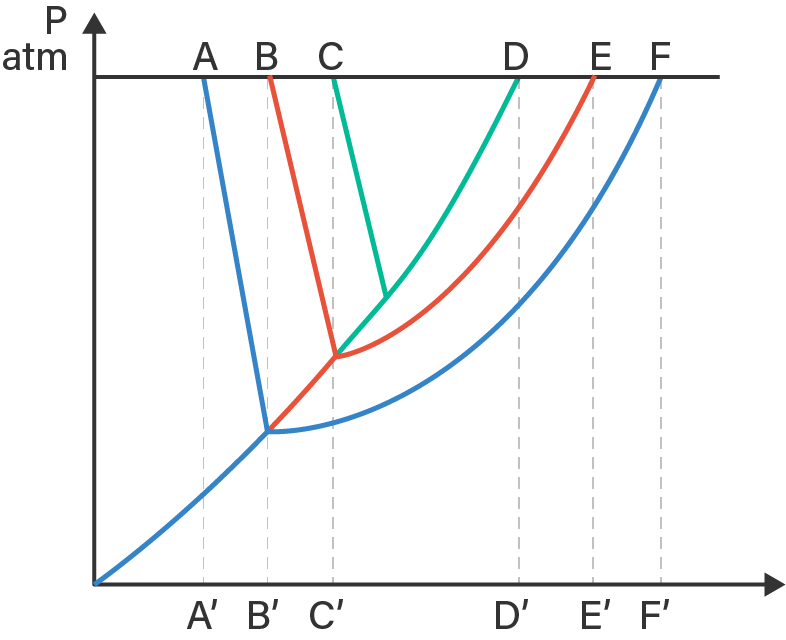
Perhatikan diagram P-T larutan glukosa 0,1 m dan larutan NaCl 0,1 m berikut!
Ilustrator: Zain M.
Berdasarkan diagram tersebut, garis yang menunjukkan penurunan titik beku larutan glukosa 0,1 m dan larutan NaCl 0,1 m berturut-turut adalah ....
Berdasarkan diagram tersebut, garis yang menunjukkan penurunan titik beku larutan glukosa 0,1 m dan larutan NaCl 0,1 m berturut-turut adalah ....
Iklan
S. Lubis
Master Teacher
1
4.6 (12 rating)
Najwa Asri Hyacinta
Pembahasan lengkap banget Ini yang aku cari! Mudah dimengerti Makasih ❤️
Fari Zahran Arrafi
Makasih ❤️ Mudah dimengerti Pembahasan lengkap banget Ini yang aku cari! Bantu banget
Ageng Zahwa Revanisa
Pembahasan lengkap banget Ini yang aku cari!
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia















