Iklan
Pertanyaan
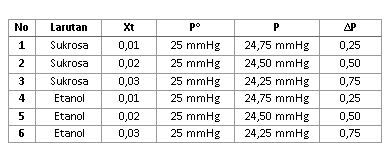
Perhatikan tabel di bawah ini!
Berdasarkan data tabel di atas : Perhatikan larutan No. 1 dan 2 apakah zat terlarutnya sama? Bagaimana dengan tekanan uapnya? Adakah pengaruh nilai fraksi mol zat terlarut terhadap penurunan tekanan uap yang terjadi? Bagaimana hubungan antara nilai fraksi mol zat terlarut dengan penurunan tekanan uap larutan? Bagaimana pula hubungan antara nilai fraksi mol zat terlarut dengan tekanan uap larutan?
Berdasarkan data tabel di atas :
- Perhatikan larutan No. 1 dan 2 apakah zat terlarutnya sama? Bagaimana dengan tekanan uapnya?
- Adakah pengaruh nilai fraksi mol zat terlarut terhadap penurunan tekanan uap yang terjadi?
- Bagaimana hubungan antara nilai fraksi mol zat terlarut dengan penurunan tekanan uap larutan?
- Bagaimana pula hubungan antara nilai fraksi mol zat terlarut dengan tekanan uap larutan?
Iklan
SL
S. Lubis
Master Teacher
Mahasiswa/Alumni Universitas Sumatera Utara
Jawaban terverifikasi
2
4.0 (5 rating)
PA
Preda Aurora Maulidya
Makasih ❤️ Bantu banget
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia