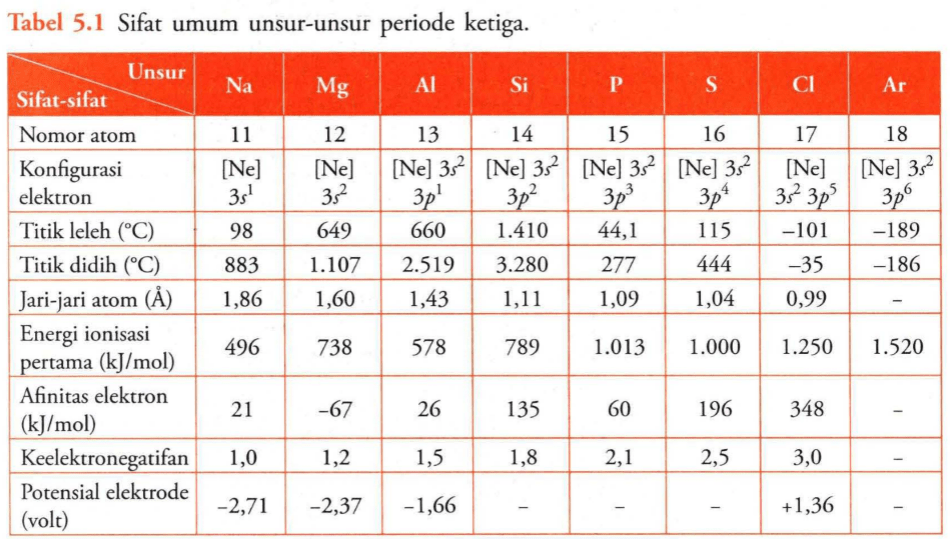
Unsur-unsur periode ketiga dari Na ke Cl memiliki keteraturan sifat seperiode yang sama. Keteraturan sifat yang dimaksud diantaranya adalah jari-jari atom dan energi ionisasi.
- Jari-jari atom adalah jarak dari inti atom ke orbital elektron terluar. Dalam satu periode dari kiri ke kanan, nomor atom semakin meningkat, jumlah proton semakin meningkat serta muatan efektif inti akan semakin meningkat pula sehingga jari-jari semakin kecil.
- Energi ionisasi adalah energi yang diperlukan untuk melepaskan elektron terluar oleh suatu ion/atom dalam wujud gas.
a. Jari-jari atom berkurang dari Na ke Cl.
Unsur Na hingga ke Cl memiliki muatan inti yang semakin bertambah dan semakin kuat menarik elektron terluar sehingga jarak kulit terluar ke inti semakin dekat atau jari-jari makin kecil.
b. Energi ionisasi Al lebih rendah daripada Mg.
Energi ionisasi yang rendah ataupun tinggi dipengaruhi oleh konfigurasi elektron penuh yang lebih stabil. Magnesium memiliki konfigurasi penuh pada kulit terluarnya dibandingkan aluminium.

Konfigurasi elektron penuh pada unsur magnesium lebih stabil sehingga sulit untuk melepaskan elektron sehingga diperlukan energi yang besar artinya energi ionisasi Mg lebih tinggi dibanding Al.
c. Energi ionisasi S lebih rendah daripada P.
Energi ionisasi yang rendah ataupun tinggi dipengaruhi oleh konfigurasi elektron penuh yang lebih stabil. Fosforus memiliki konfigurasi setengah penuh pada kulit terluarnya dibandingkan belerang.

Konfigurasi elektron setengah penuh pada unsur fosforus lebih stabil sehingga sulit untuk melepaskan elektron sehingga diperlukan energi yang besar artinya energi ionisasi P lebih tinggi dibanding S.
Dengan demikian, dapat disimpulkan bahwa:
- Jari-jari atom berkurang dari Na ke Cl karena jumlah proton dan muatan efektif inti semakin bertambah.
- Energi ionisasi Al lebih rendah daripada Mg karena elektron terluar Mg sudah stabil dan terisi penuh pada subkulit 3s sehingga sulit dilepaskan.
- Energi ionisasi S lebih rendah daripada P karena elektron terluar P sudah stabil dan terisi setengah penuh pada subkulit 3p sehingga sulit dilepaskan.
Jadi, jari-jari atom dari Na ke Cl berkurang, energi ionisasi Al lebih kecil daripada Mg, serta energi ionisasi S lebih rendah daripada P.