Iklan
Iklan
Pertanyaan
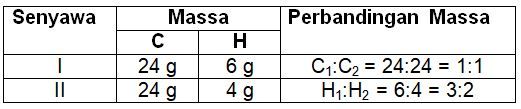
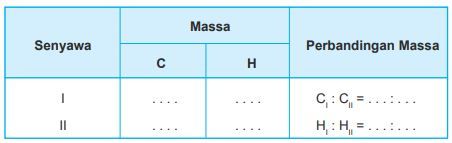
Analisis dua buah senyawa yang terdiri dari karbon dan hidrogen memberikan hasil-hasil sebagai berikut. • Senyawa pertama terdiri dari 24 gram karbon dan 6 gram hidrogen. • Senyawa kedua terdiri dari 24 gram karbon dan 4 gram hidrogen. Masukkan hasil analisis tersebut pada tabel seperti berikut dan tentukan perbandingan massanya. Apakah kedua senyawa ini memenuhi Hukum Dalton?
Analisis dua buah senyawa yang terdiri dari karbon dan hidrogen memberikan hasil-hasil sebagai berikut.
• Senyawa pertama terdiri dari 24 gram karbon dan 6 gram hidrogen.
• Senyawa kedua terdiri dari 24 gram karbon dan 4 gram hidrogen.
Masukkan hasil analisis tersebut pada tabel seperti berikut dan tentukan perbandingan massanya.
Apakah kedua senyawa ini memenuhi Hukum Dalton?
Iklan
RA
R. Anisa
Master Teacher
Mahasiswa/Alumni Universitas Negeri Semarang
Jawaban terverifikasi
3
5.0 (1 rating)
Iklan
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2024 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia