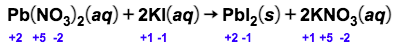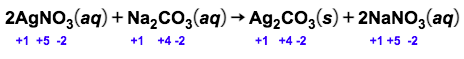Iklan
Pertanyaan
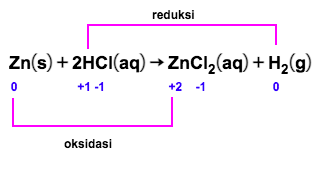
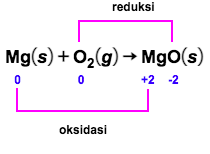
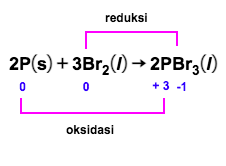
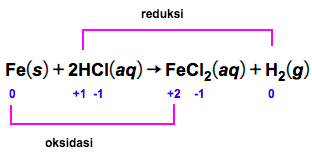
Amati hasil eksperimen yang ditunjukkan pada gambar berikut! Hasil eksperimen mana yang merupakan reaksi redoksdan mana yang bukan reaksi redoks? Jelaskan jawaban kalian dan tuliskan reaksinya! A.Larutan Pb ( NO 3 ) 2 dicampur dengan larutan KI menghasilkanendapan PbI 2 . B.Logam Zn dimasukkanke dalamlarutan asam klorida menghasilkan gas hidrogen. C. Larutan AgNO 3 dicampur dengan larutan Na 2 CO 3 menghasilkan endapan Ag 2 CO 3 . D.Logam magnesium terbakar di udara menghasilkan MgO. E. Fosfor padat bereaksi dengan bromin ( Br 2 ) menghasilkan ( PBr 3 ) . F.Besi dimasukkan ke dalam larutan asam klorida menghasilkan gas hidrogen.
Amati hasil eksperimen yang ditunjukkan pada gambar berikut! Hasil eksperimen mana yang merupakan reaksi redoks dan mana yang bukan reaksi redoks? Jelaskan jawaban kalian dan tuliskan reaksinya!
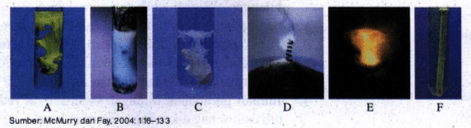
A. Larutan dicampur dengan larutan KI menghasilkan endapan .
B. Logam Zn dimasukkan ke dalam larutan asam klorida menghasilkan gas hidrogen.
C. Larutan dicampur dengan larutan menghasilkan endapan .
D. Logam magnesium terbakar di udara menghasilkan MgO.
E. Fosfor padat bereaksi dengan bromin menghasilkan .
F. Besi dimasukkan ke dalam larutan asam klorida menghasilkan gas hidrogen.
Iklan
S. Lubis
Master Teacher
1
4.1 (15 rating)
Ober Helmawan
Ini yang aku cari!
TERIMA SYUKURMAN HULU
Pembahasan lengkap banget
Amelya Ferlyanti
Pembahasan lengkap banget Mudah dimengerti Ini yang aku cari! Bantu banget Makasih ❤️
Lisa Nur Rohmawati
Mudah dimengerti Makasih ❤️
Yanita zai
Pembahasan terpotong
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia