JM
Joko M
18 November 2021 23:55
Iklan
JM
Joko M
18 November 2021 23:55
Pertanyaan
Untuk reaksi kesetimbangan: H2(g) +I2(g) ↔ 2HI(g). Gambarkan grafik konsentrasi terhadap waktu untuk reaksi kesetimbangan tersebut.
13
1
Iklan
SS
S. SheilaTeacherAssisstant
Mahasiswa/Alumni Universitas Pancasila
01 Februari 2022 07:28
Jawaban terverifikasi
Hai Joko, kakak bantu ya. Jawaban pertanyaan kamu adalah seperti pada gambar di bawah. Kesetimbangan Dinamis merupakan suatu proses bolak balik dengan laju yang sama untuk kedua arah. Syarat-syarat terjadinya suatu reaksi setimbang: • Reaksi Bolak Balik Terjadi pada reaksi homogen (fasa pereaksi dan hasil reaksinya sama, misalnya reaksi-reaksi gas dan larutan) dan umumnya reaksi heterogen (fasa pereaksi dan hasil reaksinya berbeda) pada suhu tinggi. • Sistem Tertutup Suatu sistem reaksi di mana baik zat-zat yang bereaksi maupun zat-zat hasil reaksi tidak ada yang meninggalkan sistem. Namun, bukan berarti reaksi tersebut dilakukan pada ruang tertutup, meskipun terkadang diperlukan dilakukan pada ruang tertutup terutama untuk reaksi yang melibatkan gas. • Bersifat Dinamis Secara mikroskopis reaksi berlangsung secara terus menerus dalam dua arah dengan laju reaksi pembentukan sama dengan laju reaksi baliknya. Laju Reaksi adalah berkurangnya konsentrasi pereaksi dan bertambahnya konsentrasi zat hasil reaksi setiap satu satuan waktu (detik). Satuannya: M (molaritas)/detik = M/detik. Perubahan molekul A menjadi molekul B yang dinyatakan dengan persamaan reaksi: A → B Berkurangnya jumlah molekul A dan bertambahnya molekul B diikuti dengan selang waktu 1 detik. Dengan demikian laju reaksi dapat dinyatakan dengan: V = -[ΔA]/det atau +[ΔB]/det Hukum Laju Reaksi atau Persamaan Laju Reaksi … “Laju reaksi umumnya tergantung pada konsentrasi awal dari zat-zat pereaksi” Secara umum untuk reaksi: pA + qB → rC maka v = k [A]ᵐ [B]ⁿ di mana: v = laju reaksi (M/det) k = tetapan laju reaksi m = tingkat reaksi (orde reaksi) terhadap A n = tingkat reaksi (orde reaksi) terhadap B [A] = konsentrasi awal A (M) [B] = konsentrasi awal B (M) Tingkat reaksi (orde reaksi) total = m + n Pada soal kamu, diminta untuk menggambar grafik untuk reaksi kesetimbangan: H₂(g) + I₂(g) ↔ 2HI(g). Dimana yang diminta adalah grafik konsentrasi terhadap waktu. Sehingga berdasarkan konsep laju reaksi, maka laju reaksi H₂ dan I₂ akan terus berkurang setiap detik, sementara HI akan terus bertambah sampai terbentuknya HI, dan dalam hal ini, karena yang ditanyakan adalah konsentrasi terhadap waktu, maka terdapat beberapa kemungkinan yaitu saat konsentrasi H₂ > I₂ > HI, I₂ > H₂ > HI, H₂ > HI > I₂, I₂ > HI > H₂, HI > H₂ > I2, HI > I₂ > H₂, dan H₂ = I₂ = HI pada kesetimbangan sehingga dalam bentuk grafik dinyatakan seperti pada gambar di bawah. Jadi, grafik hubungan konsentrasi dengan waktu untuk reaksi H₂(g) + I₂(g) ↔ 2HI(g) adalah seperti pada gambar di bawah. Semoga membantu ya. Terima kasih sudah bertanya di RoboGuru.
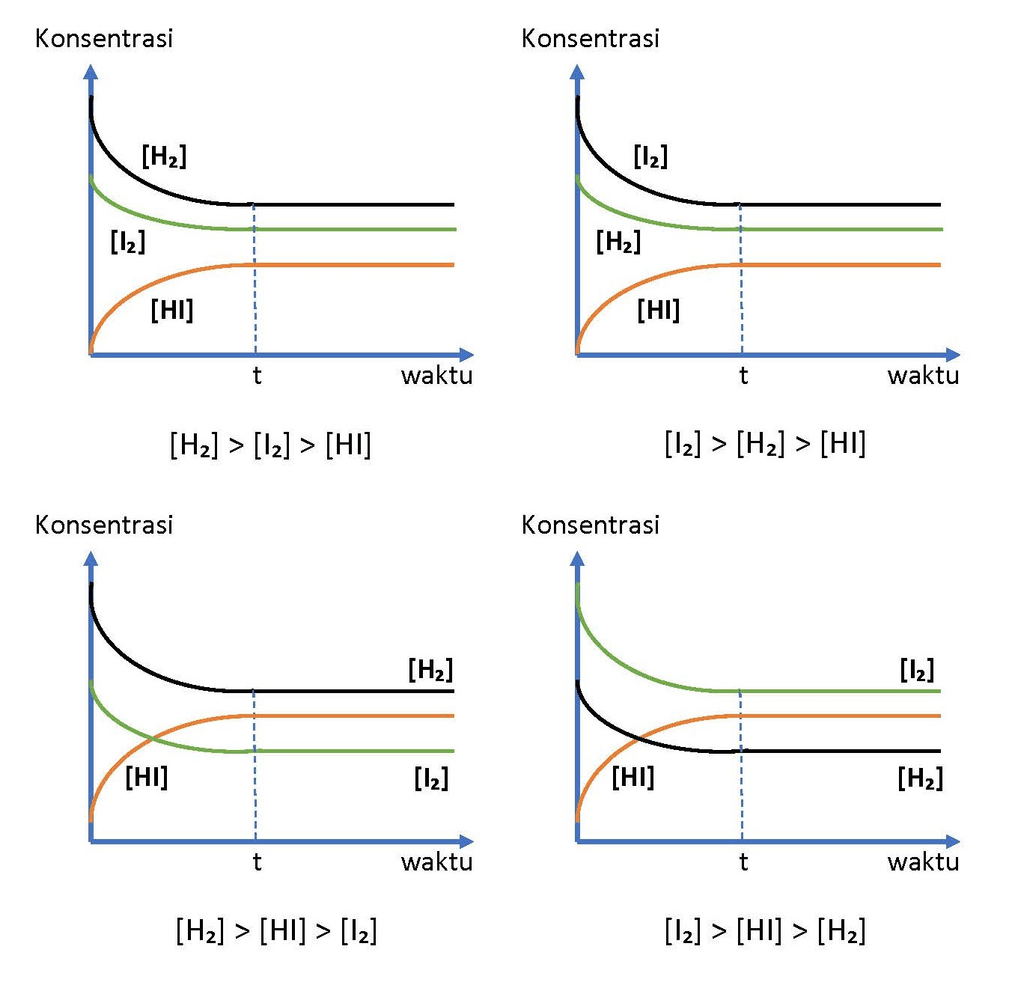
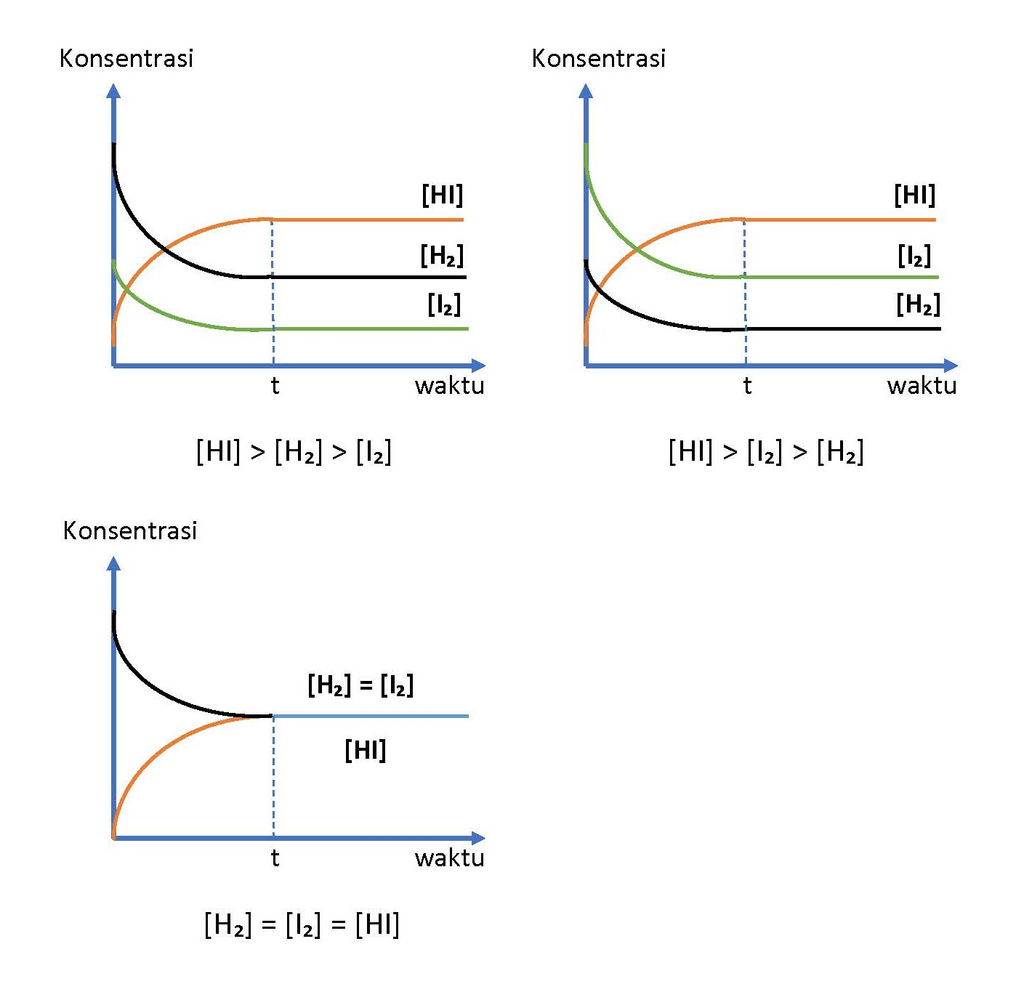
· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



