EE
Esther E
27 Juni 2022 03:29
Iklan
EE
Esther E
27 Juni 2022 03:29
Pertanyaan
Untuk asam lemah HA dengan nilai pKa = 4 dan konsentrasi sebesar 0,1 M. Larutan penyangga dapat dihasilkan dari 0,1 M larutan HA 20 mL dicampurkan dengan 0,1 M larutan NaOH 10 mL. Hitunglah pH larutan yang dihasilkan !
2
1
Iklan
SZ
S. Zulaihah
Mahasiswa/Alumni Universitas Negeri Surabaya
27 Juni 2022 09:54
Jawaban terverifikasi
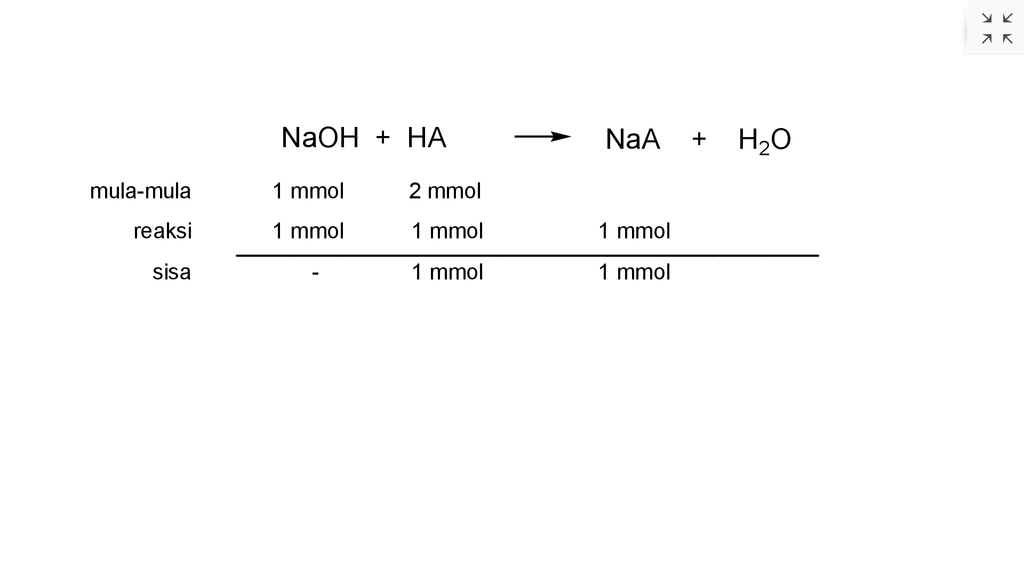
Jawaban yang benar adalah 4. Larutan asam atau basa lemah yang direaksikan dengan larutan asam atau basa kuat maka akan terjadi 2 kemungkinan. 1. Jika asam atau basa lemah bersisa maka akan terbentuk larutan penyangga. 2. Jika kedua pereaksi habis bereaksi maka akan terjadi hidrolisis parsial (sebagian). ▪︎menentukan mol HA mol HA = M × V mol HA = 0,1 M × 20 ml mol HA = 2 mmol ▪︎ menentukan mol NaOH mol NaOH = M × V mol NaOH = 0,1 M × 10 ml mol NaOH = 1 mmol Reaksi yang terjadi adalah seperti pada lampiran berikut ini. Dari perhitungan tersebut, mol HCOOH (asam lemah) bersisa sehingga larutan yang terbentuk merupakan larutan penyangga asam. Konsentrasi H⁺ untuk penyangga asam adalah [H⁺] = Ka × (mol asam / mol garam) ▪︎menentukan pH pKa = 4 Ka = 10⁻⁴ [H⁺] = Ka × (mol asam / mol garam) [H⁺] = 10⁻⁴ × (1 mmol / 1 mmol) [H⁺] = 10⁻⁴ M pH = - log 10⁻⁴ pH = 4 Jadi, pH larutan adalah 4.
· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



