HI
Haqqi I
09 Maret 2022 13:17
Iklan
HI
Haqqi I
09 Maret 2022 13:17
Pertanyaan
Timbang isi dari 10 kapsul yang masing-masing mengandung 100 atau 300 mg Gabapentin (BM = 171,240). Kuantitas yang ditimbang secara akurat setara dengan 200 mg Gabapentin dipindahkan ke dalam labu terkalibrasi 100 mL. Larutkan Gabapentin dalam labu dengan 60 mL asam asetat glasial. Kocok isi labu selama 15 menit. Encerkan menggunakan asam yang sama, yaitu asam asetat glasial, hingga mencapai tanda batas kalibrasi. Aduk rata dan saring menggunakan kertas saring Whatman No. 42. Buang bagian 10 mL pertama filtrat. 10 ml filtrat dianalisis mengikuti prosedur: Tambahkan dua tetes indikator kristal violet 0,2% ke dalam labu titrasi. Titrasi campuran dengan larutan standar asam perklorat 0,01 M sampai titik akhir berwarna biru murni diperlukan titer sebanyak: 11,72 ml. Pada titrasi blanko dengan cara yang sama tanpa obat, diperoleh: 0,05 ml. Berapa kesetaraan (mg) gabapentin per ml asam perklorat 0,01 M? Mengapa tidak diperlukan penambahan Hg(OAc)2? Serta hitung kadar (%) Gabapentin dalam serbuk tablet yang ditimbang
2
1
Iklan
NI
N. Izzatun
Mahasiswa/Alumni Universitas Gadjah Mada
16 Maret 2022 05:04
Jawaban terverifikasi
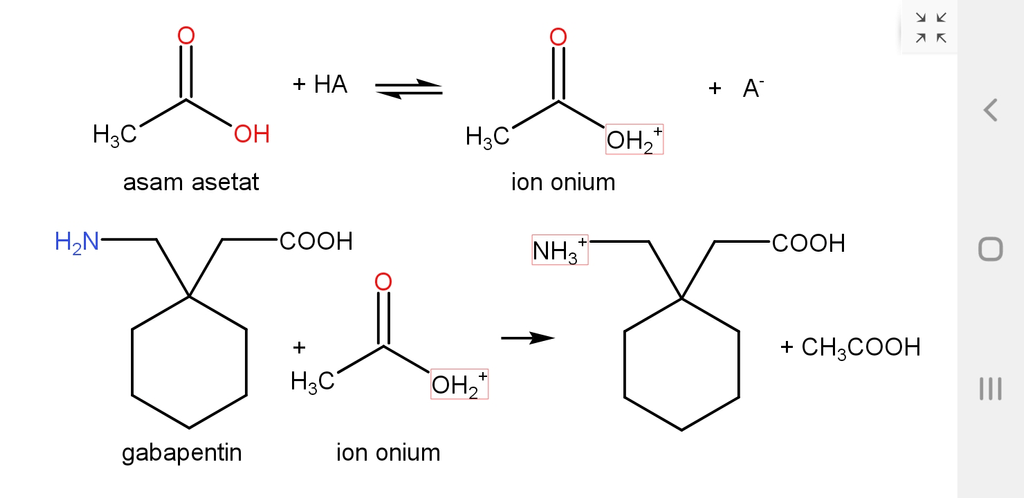
Hai Haqqi, Kakak bantu jawab ya.. Jawabannya : 1.) Kesetaraan gabapentin = 1712,4 mg per ml asam perklorat 0,01M. 2.) Tidak diperlukan penambahan Hg(OAc)2 karena basa yang dianalisis (gabapentin) dalam bentuk garam yang berasal dari asam lemah, sehingga penghilangan anion yang berasal dari asam kurang begitu penting. 3.) Kadar gabapentin = 9,9918 %b/b Artinya terdapat 9,9918 gram gabapentin/100 gram sampel ● maka dalam 200 mg sampel terdapat 19,9836 mg gabapentin Pembahasan : ☆ Titrasi gabapentin dalam asam asetat glasial merupakan titrasi bebas air (TBA). Metode ini mempunyai 2 keuntungan : a. Metode ini cocok untuk titrasi asam-asam atau basa-basa yang sangat lemah b. Pelarut yang digunakan adalah pelarut organik yang juga mampu melarutkan analit-analit organik. Prosedur yang paling umum untuk titrasi basa-basa organik adalah dengan menggunakan titran asam perklorat dalam asam asetat. ☆ teori TBA secara singkat sebagai berikut : Air dapat bersifat asam lemah dan basa lemah. Oleh karena itu dalam lingkungan air, air dapat berkompetisi dengan asam-asam atau basa-basa yang sangat lemah dalam hal menerima atau memberi proton. Adanya pengaruh kompetisi ini berakibat pada kecilnya titik infleksi pada kurva titrasi asam sangat lemah atau basa sangat lemah sehingga mendekati batas pH 0 dan 14. Oleh karena itu deteksi titik akhir titrasi sangat sulit. Berbagai macam pelarut organik dapat digunakan untuk mengganti air karena pelarut-pelarut ini kurang berkompetisi secara efektif dengan analit dalam hal menerima atau memberi proton. ☆ titrasi bebas air basa lemah. Asam asetat merupakan penerima proton yang sangat lemah sehingga tidak berkompetisi secara efektif dengan basa-basa lemah dalam hal menerima proton. Hanya asam yang sangat kuat yang mampu memprotonasi asam asetat sesuai dengan persamaan reaksi pada gambar terlampir. Asam asetat akan menjadi ion onium yang bermuatan positif (perhatikan gambar terlampir). Asam perklorat dalam larutan asam asetat merupakan asam yang paling kuat di antara asam-asam umum yang digunakan untuk titrasi basa lemah dalam medium bebas air. ☆ reaksi dalam titrasi gabapentin bisa dilihat pada gambar terlampir. Pada reaksi tersebut terlihat bahwa 1 mol gabapentin setara dengan 1 mol asam asetat sehingga valensinya (n) = 1 Maka BM = BE dan N = M Dari pehitungan (dalam gambar terlampir) didapatkan nilai kesetaraan gabapentin per ml asam perklorat 0,01M adalah 1712,4 mg ☆ pada titrasi ini tidak diperlukan penambahan Hg(OAc)2 karena basa yang dianalisis (gabapentin) dalam bentuk garam yang berasal dari asam lemah, sehingga penghilangan anion yang berasal dari asam kurang begitu penting. Contoh garam basa yang berasal dari asam lemah adalah suksinat, tartrat atau asetat. Akan tetapi, jika basa dalam bentuk garam klorida atau bromida , maka bromida dan klorida harus dihilangkan sebelum dititrasi dengan penambahan merkuri asetat atau Hg(OAc)2. Adanya asam klorida/asam bromida harus dihindari karena bisa mengakibatkan penetapan kadar tidak kuantitatif karena asam-asam ini juga bisa bereaksi dengan senyawa sampel yang bersifat basa. ☆perhitungan kadar gabapentin bisa dilihat pada gambar terlampir. Diketahui : V titran = V asam perklorat - V blanko = 11,72 ml - 0,05 ml = 11,67 ml N titran = N asam perklorat, karena valensi 1 maka N=M= 0.01 N dan BE = BM = 171,240 gram/mol Dari perhitungan didapatkan kadar gabapentin = 9,9918 %b/b Artinya terdapat 9,9918 gram gabapentin/100 gram sampel ● maka dalam 200 mg sampel terdapat 19,9836 mg gabapentin Semoga membantu, Terimakasih sudah bertanya di roboguru.

· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



