Esther E
30 Januari 2023 05:28
Iklan
Esther E
30 Januari 2023 05:28
Pertanyaan
Tentukan pH campuran 100 mL larutan CH3COOH 0,8 M dan 100 mL larutan NaOH 0,2 M ! (Ka CH3COOH = 1,8 x 10^-5)
5
1
Iklan
Y. Frando
27 September 2023 03:44
<p>Jawaban yang benar adalah 4,27.</p><p> </p><p>Diketahui:</p><p>Pencampuran dua larutan</p><p>100 mL NaOH 0,2 M dan 100 mL CH₃COOH 0,8 M</p><p>Ka CH₃COOH = 1,8 x 10⁻⁵</p><p> </p><p>Ditanya:</p><p>pH campuran = ...?</p><p> </p><p>Jawab:</p><p>Larutan penyangga (buffer) merupakan larutan yang dapat mempertahankan pH jika ditambahkan sedikit asam atau basa kuat dan pengenceran.</p><p>Perhitungan larutan penyangga asam adalah:</p><p>[H+] = Ka x (na/ng).</p><p> </p><p>Sehingga: pH = - log [H+].</p><p> </p><p>Keterangan:</p><p>[H+] = konsentrasi ion H+</p><p>Ka = tetapan ionisasi asam</p><p>na = mol sisa asam lemah</p><p>ng = mol garam terbentuk</p><p>pH = derajat keasaman.</p><p> </p><p>Dari soal di atas diperoleh perhitungan berikut:</p><p>n CH3COOH = M x V = 0,8 M x 100 mL = 80 mmol.</p><p>n NaOH = M x V = 0,2 M x 100 mL = 20 mmol.</p><p> </p><p>Selanjutnya reaksi MRS terlampir pada foto di bawah.</p><p>[H+] = Ka x na/ng</p><p>[H+] = 1,8 x 10⁻⁵ x (60 mmol/20 mmol)</p><p>[H+] = 5,4 x 10⁻⁵ M.</p><p> </p><p>Maka, pH nya adalah:</p><p>pH = - log [H+] </p><p>pH = - log (5,4 x 10⁻⁵)</p><p>pH = 5 - log 5,4</p><p>pH = 5 - 0,73</p><p>pH = 4,27.</p><p> </p><p>Jadi, pH campuran yang terjadi adalah 4,27.</p>
Jawaban yang benar adalah 4,27.
Diketahui:
Pencampuran dua larutan
100 mL NaOH 0,2 M dan 100 mL CH₃COOH 0,8 M
Ka CH₃COOH = 1,8 x 10⁻⁵
Ditanya:
pH campuran = ...?
Jawab:
Larutan penyangga (buffer) merupakan larutan yang dapat mempertahankan pH jika ditambahkan sedikit asam atau basa kuat dan pengenceran.
Perhitungan larutan penyangga asam adalah:
[H+] = Ka x (na/ng).
Sehingga: pH = - log [H+].
Keterangan:
[H+] = konsentrasi ion H+
Ka = tetapan ionisasi asam
na = mol sisa asam lemah
ng = mol garam terbentuk
pH = derajat keasaman.
Dari soal di atas diperoleh perhitungan berikut:
n CH3COOH = M x V = 0,8 M x 100 mL = 80 mmol.
n NaOH = M x V = 0,2 M x 100 mL = 20 mmol.
Selanjutnya reaksi MRS terlampir pada foto di bawah.
[H+] = Ka x na/ng
[H+] = 1,8 x 10⁻⁵ x (60 mmol/20 mmol)
[H+] = 5,4 x 10⁻⁵ M.
Maka, pH nya adalah:
pH = - log [H+]
pH = - log (5,4 x 10⁻⁵)
pH = 5 - log 5,4
pH = 5 - 0,73
pH = 4,27.
Jadi, pH campuran yang terjadi adalah 4,27.
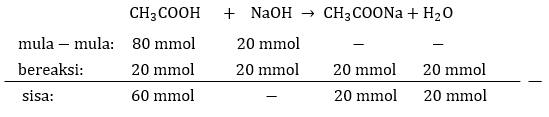
· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



