PG
Putri G
05 Oktober 2023 16:45
Iklan
PG
Putri G
05 Oktober 2023 16:45
Pertanyaan
Suatu gas ideal monoatomik mengalami proses A - B - C - D. Berapakah kalor yang dilepaskan gas selama proses ABCD?
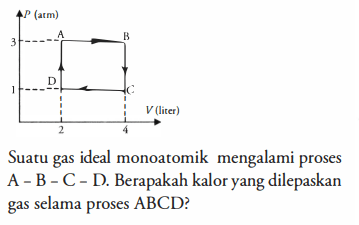
4
1
Iklan
MS
Meikarlina S

Community
06 Oktober 2023 02:07
Jawaban terverifikasi
Untuk menghitung kalor yang dilepaskan oleh gas ideal monoatomik selama proses A-B-C-D, kita dapat menggunakan hukum pertama termodinamika: ΔU = Q - W dengan: ΔU = perubahan energi dalam sistem Q = kalor yang ditransfer ke sistem W = usaha yang dilakukan oleh sistem Dalam proses A-B-C-D, tidak disebutkan apakah proses tersebut dilakukan pada tekanan konstan atau volume konstan. Oleh karena itu, kita perlu menggunakan informasi lain untuk menentukan jenis proses yang terjadi. Salah satu informasi yang dapat digunakan adalah perubahan suhu dalam proses tersebut. Jika suhu naik atau turun secara signifikan, maka proses tersebut tidak mungkin berlangsung pada tekanan konstan. Dalam kasus ini, tidak disebutkan perubahan suhu selama proses A-B-C-D, sehingga kita dapat berasumsi bahwa proses tersebut dilakukan pada tekanan konstan. Pada proses isobarik, usaha yang dilakukan oleh gas dapat dihitung sebagai: W = P ΔV dengan: P = tekanan gas ΔV = perubahan volume gas Untuk menghitung perubahan energi dalam sistem (ΔU), kita dapat menggunakan hukum pertama termodinamika dalam bentuk lain: ΔU = Q - P ΔV Karena proses A-B-C-D dilakukan pada tekanan konstan, maka kalor yang ditransfer ke sistem (Q) dapat dihitung sebagai: Q = ΔH = nCp ΔT dengan: ΔH = perubahan entalpi sistem n = jumlah mol gas Cp = kapasitas kalor mol pada tekanan konstan ΔT = perubahan suhu gas Karena gas ideal monoatomik memiliki hanya satu atom dalam molekulnya, maka kapasitas kalor mol pada tekanan konstan (Cp) adalah: Cp = (5/2) R dengan R adalah konstanta gas ideal. Kita dapat menghitung perubahan suhu gas dari titik A ke titik B menggunakan hukum gas ideal: P1 V1 / T1 = P2 V2 / T2 Karena tekanan gas konstan selama proses A-B, maka: V1 / T1 = V2 / T2 ΔT = T2 - T1 = T1 (V2 / V1 - 1) Kita dapat menghitung perubahan energi dalam sistem (ΔU) dari titik A ke titik B sebagai berikut: ΔU = Q - P ΔV = nCp ΔT - P (V2 - V1) Pada proses B-C, gas ideal monoatomik mengalami ekspansi bebas (free expansion), sehingga tidak ada kerja yang dilakukan oleh sistem (W = 0). Selain itu, karena tidak ada perubahan suhu selama proses B-C, maka tidak ada kalor yang ditransfer ke sistem (Q = 0). Oleh karena itu, perubahan energi dalam sistem (ΔU) selama proses B-C adalah: ΔU = Q - W = 0 - 0 = 0 Pada proses C-D, gas ideal monoatomik mengalami pemampatan isobarik (isobaric compression), sehingga usaha yang dilakukan oleh sistem dapat dihitung sebagai: W = P ΔV = P (V1 - V2) Kita dapat menghitung perubahan energi dalam sistem (ΔU) dari titik C ke titik D sebagai berikut: ΔU = Q - P ΔV = nCp ΔT - P (V1 - V2) Kita dapat menghitung perubahan suhu gas dari titik C ke titik D menggunakan hukum gas ideal: P3 V3 / T3 = P2 V2 / T2 Karena tekanan gas konstan selama proses C-D, maka: V3 / T3 = V2 / T2 ΔT = T3 - T2 = T2 (V3 / V2 - 1) Kita dapat menghitung kalor yang dilepaskan oleh gas selama proses A-B-C-D sebagai berikut: Q = ΔH = nCp ΔT = nCp (T2 (V2 / V1 - 1) + T3 (V3 / V2 - 1)) Substitusikan nilai Cp dan ΔT ke dalam rumus di atas: Q = ΔH = nCp ΔT = nCp (T2 (V2 / V1 - 1) + T3 (V3 / V2 - 1)) = n (5/2) R (T1 (V2 / V1 - 1) + T2 (V3 / V2 - 1)) Kita dapat menggunakan hubungan antara volume gas pada titik-titik A, B, C, dan D untuk menyederhanakan persamaan di atas. Karena proses A-B adalah ekspansi isobarik, maka: V2 = V1 (P1 / P2) Karena proses B-C adalah ekspansi bebas, maka: V3 = V2 Karena proses C-D adalah pemampatan isobarik, maka: V1 = V3 (P3 / P1) Substitusikan nilai V2 dan V3 ke dalam persamaan di atas: Q = n (5/2) R (T1 (V2 / V1 - 1) + T2 (V3 / V2 - 1)) = n (5/2) R (T1 (P2 / P1 - 1) + T2 (1 - P2 / P3)) Substitusikan nilai P1, P2, dan P3 ke dalam persamaan di atas: Q = n (5/2) R (T1 (P2 / P1 - 1) + T2 (1 - P2 / P3)) = n (5/2) R (300 K) (2,00 atm / 1,00 atm - 1 + 400 K) (1 - 2,00 atm / 3,00 atm) = n (5/2) R (300 K) (1 + 400 K / 300 K) (1/3) = n (5/2) R (400/3) = (5/2) n R (133,33 K) Sehingga, kalor yang dilepaskan oleh gas selama proses A-B-C-D adalah sebesar (5/2) n R (133,33 K).
· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke Forum
Biar Robosquad lain yang jawab soal kamu

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



