AR
Andira R
19 Februari 2022 16:00
Iklan
AR
Andira R
19 Februari 2022 16:00
Pertanyaan
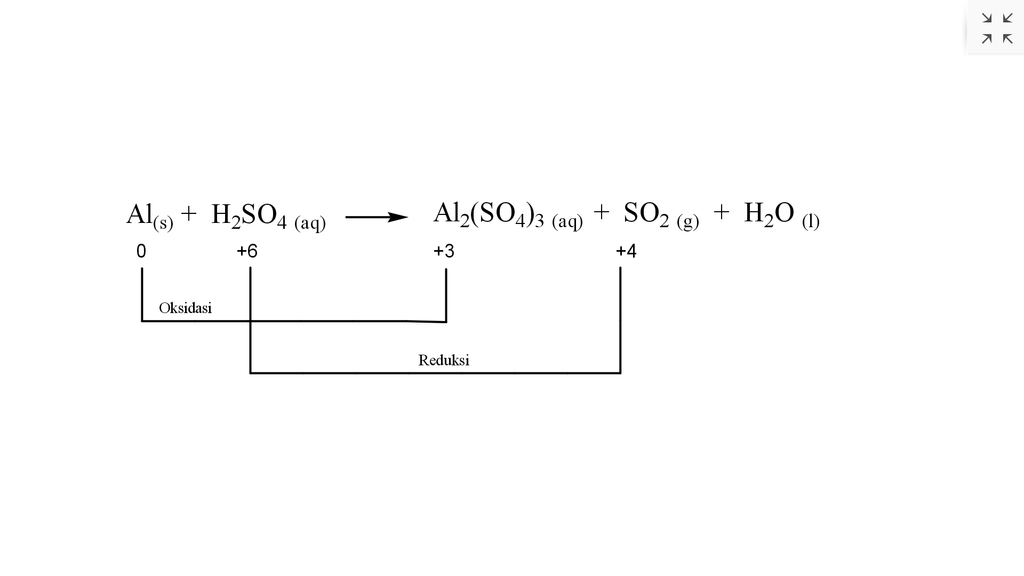
Setarakan reaksi berikut. Al(s) + H₂SO₄(aq) → Al₂(SO₄)₃(aq) + SO₂(g) + H₂O(l) Tentukan zat yang berperan sebagai oksidator dan reduktor pada reaksi di atas.
30
1
Iklan
SZ
S. Zulaihah
Mahasiswa/Alumni Universitas Negeri Surabaya
27 Februari 2022 08:48
Jawaban terverifikasi
Hallo Andira, kakak bantu untuk menjawabnya, ya. Jawabannya adalah yang bertindak sebagai reduktor yaitu Al dan oksidatornya yaitu H2SO4. Untuk lebih jelasnya, yuk simak pembahasan dibawah ini. Oksidator adalah zat yang mengalami reduksi, sedangkan reduktor adalah zat yang mengalami oksidasi. Untuk mengetahui oksidator dan reduktornya, maka harus menentukan bilangan oksidasi dari masing-masing unsur yang terlibat. Dalam menentukan bilangan oksidasi, harus mengikuti beberapa aturan, diantaranya yaitu: 1. Unsur bebas selalu mempunyai bilangan oksidasi 0. 2. Umumnya unsur H mempunyai bilangan oksidasi (+1). 3. Umumnya unsur O mempunyai bilangan oksidasi (-2). 4. Unsur logam mempunyai bilangan oksidasi selalu bertanda positif. 5. Jumlah bilangan oksidasi unsur-unsur dalam senyawa sama dengan 0. Padaa reaksi: Al (s) + H2SO4 (aq) --- Al2(SO4)3 (aq) + SO2 (g) + H2O (l) dapat ditentukan bilangan oksidasinya sebagai berikut: Bilangan oksidasi unsur Al (unsur bebas) = 0 Bilangan oksidasi S pada H2SO4: (2×biloks H) + (1×biloks S) + (4×biloks O) = 0 (2×(+1)) + biloks S + (4×(-2)) = 0 (+2) + biloks S + (-8) = 0 biloks S = 8-2 biloks S = +6 Pada senyawa Al2(SO4)3 dapat diuraikan menjadi ion-ionnya. Al2(SO4)3 --- Al3+ + SO4 2- Sehingga dapat diketahui biloks Al adalah (+3), sedangkan untuk biloks unsur S dalam senyawa Al2(SO4)3 yaitu: (2×biloks Al) + (3×biloksS) + (12×biloks O) = 0 (2×(+3)) + (3×biloks S) + (12×(-2)) = 0 (+6) + (3×biloks S) + (-24) = 0 3×biloks S = 24-6 biloks S = 18/3 biloks S = +6 Bilangan oksidasi unsur S dalam SO2 yaitu: (1×biloks S) + (2×biloks O) = 0 biloks S + (2×(-2)) = 0 biloks S = +4 Dari perhitungan diatas dapat dituliskan dalam bentuk persamaan reaksi redoks seperti pada lampiran dibawah ini. Dari persamaan reaksi tersebut, dapat diketahui bahwa Al mengalami oksidasi menjadi Al2(SO4)3 sedangkan H2SO4 mengalami reduksi menjadi SO2. Jadi, yang bertindak sebagai reduktor adalah Al, sedangkan yang bertindak sebagai oksidatornya adalah H2SO4.
· 5.0 (2)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



