Asep K
15 Januari 2023 18:26
Iklan
Asep K
15 Januari 2023 18:26
Pertanyaan
senyawa xef4 terbentuk dari unsur gas mulia xe dan elektronegatif f. bentuk geometri dan tipe hibridisasi pada molekul xef4 adalah (na xe=54. f=9) a tetrahedron, sp3 b segiempat planar, sp3 c. segiempat planar, dsp2 d segiempat planar, sp3d2 e. tetrahedron, sp3d
4
1
Iklan
J. Siregar
Mahasiswa/Alumni Universitas Negeri Medan
25 Januari 2023 07:27
<p><strong><u>Jawaban yang benar adalah D.</u></strong></p><p> </p><p>Geometri molekul suatu senyawa dapat ditentukan dengan langkah-langkah berikut ini.</p><ul><li>Menentukan atom pusat dinyatakan dengan lambang A.</li><li>Menentukan elektron valensi atom pusat dinyatakan dengan EV.</li><li>Menentukan pasangan elektron ikatan (PEI) dinyatakan dengan X.</li><li>Menentukan pasangan elektron bebas (PEB) dinyatakan dengan E.<br>Jumlah PEB dapat ditentukan dengan rumus berikut.<br>E = EV-X/2</li></ul><p>Pada senyawa XeF<sub>4</sub>, yang berperan sebagai atom pusat adalah Xe. Xe merupakan golongan VIIIA, sehingga memiliki 8 elektron valensi. Xe mengikat 4 F sehingga memiliki PEI (X) sejumlah 4. Jumlah PEB (E) pada senyawa tersebut sebagai berikut.</p><p>E = EV-X/2</p><p>E = (8-4)/2 = 2</p><p>Tipe molekul XeF<sub>4</sub> dapat dirumuskan dengan AX<sub>4</sub>E<sub>2, </sub>maka bentuk molekulnya adalah segiempat planar.</p><p> </p><p>Hibridisasi adalah pencampuran orbital-orbital atom untuk membentuk orbital baru dengan tingkat energi yang sama di antara orbital-orbital yang dicampurkan. Orbital hasil pencampuran tersebut dinamakan orbital hibrida. Proses hibridisasi XeF<sub>4</sub> terlampir pada gambar.</p><p> </p><p>Jadi, geometri molekul dan hibridisasi XeF<sub>4</sub> adalah segiempat planar dan sp<sup>3</sup>d<sup>2</sup>.</p>
Jawaban yang benar adalah D.
Geometri molekul suatu senyawa dapat ditentukan dengan langkah-langkah berikut ini.
- Menentukan atom pusat dinyatakan dengan lambang A.
- Menentukan elektron valensi atom pusat dinyatakan dengan EV.
- Menentukan pasangan elektron ikatan (PEI) dinyatakan dengan X.
- Menentukan pasangan elektron bebas (PEB) dinyatakan dengan E.
Jumlah PEB dapat ditentukan dengan rumus berikut.
E = EV-X/2
Pada senyawa XeF4, yang berperan sebagai atom pusat adalah Xe. Xe merupakan golongan VIIIA, sehingga memiliki 8 elektron valensi. Xe mengikat 4 F sehingga memiliki PEI (X) sejumlah 4. Jumlah PEB (E) pada senyawa tersebut sebagai berikut.
E = EV-X/2
E = (8-4)/2 = 2
Tipe molekul XeF4 dapat dirumuskan dengan AX4E2, maka bentuk molekulnya adalah segiempat planar.
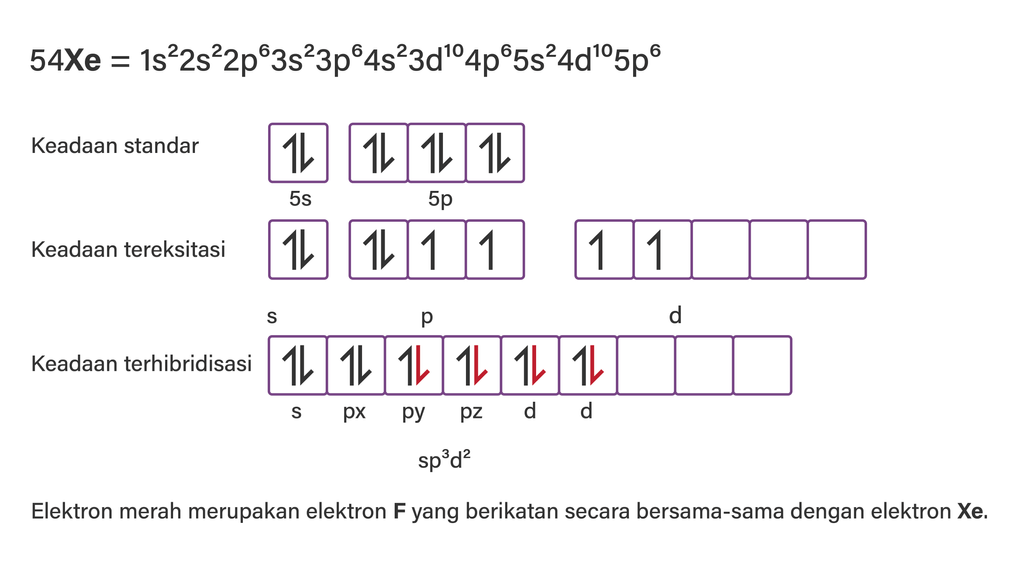
Hibridisasi adalah pencampuran orbital-orbital atom untuk membentuk orbital baru dengan tingkat energi yang sama di antara orbital-orbital yang dicampurkan. Orbital hasil pencampuran tersebut dinamakan orbital hibrida. Proses hibridisasi XeF4 terlampir pada gambar.
Jadi, geometri molekul dan hibridisasi XeF4 adalah segiempat planar dan sp3d2.
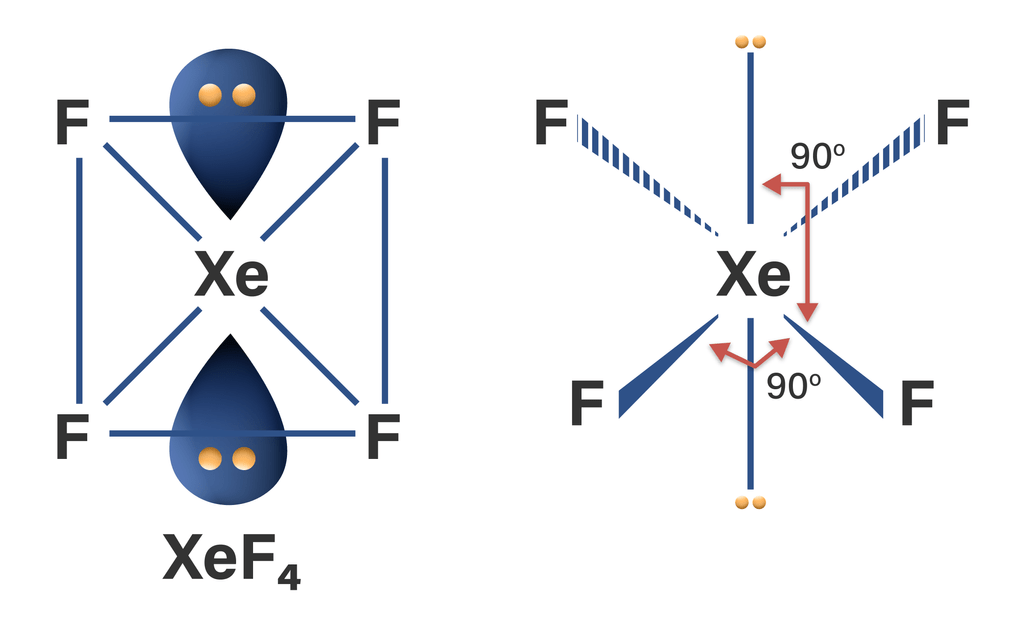
· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke Forum
Biar Robosquad lain yang jawab soal kamu

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



