Carissa C
15 Maret 2023 06:47
Iklan
Carissa C
15 Maret 2023 06:47
Pertanyaan
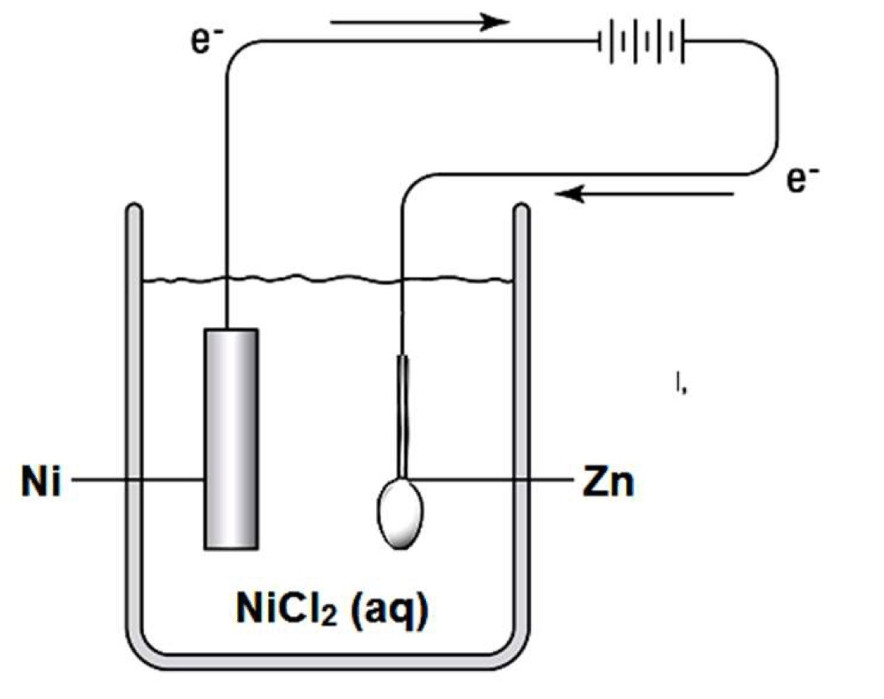
Sendok yang terbuat dari logam seng akan disepuh dengan logam nikel, seperti gambar berikut! Proses penyepuhan tersebut berlangsung selama 10 menit menggunakan arus sebesar 9,65 Ampere. Massa logam yang mengendap adalah .... (Ar Ni = 59; Zn = 65) A. 0,03 gram B. 1,77 gram C. 1,95 gram D. 3,54 gram E. 3,90 gram
Sendok yang terbuat dari logam seng akan disepuh dengan logam nikel, seperti gambar berikut!
Proses penyepuhan tersebut berlangsung selama 10 menit menggunakan arus sebesar 9,65 Ampere. Massa logam yang mengendap adalah .... (Ar Ni = 59; Zn = 65)
A. 0,03 gram
B. 1,77 gram
C. 1,95 gram
D. 3,54 gram
E. 3,90 gram
2
1
Iklan
J. Siregar
Mahasiswa/Alumni Universitas Negeri Medan
15 Maret 2023 11:49
<p><strong><u>Jawaban yang benar adalah B.</u></strong></p><p> </p><p>Pada penyepuhan sendok yang terbuat dari seng dan disepuh oleh nikel, maka yang akan mengalami elektrolisis adalah nikel (Ni).</p><p>Untuk menentukan massa logam yang mengendap yaitu logam Ni maka kita bisa menggunakan rumus hukum Faraday I.</p><p> </p><p>Hukum Faraday I menyatakan bahwa "jumlah zat yang diendapkan pada elektrolisis sebanding dengan jumlah arus yang dilewatkan".</p><p>w = (Ar/n) × (Q/F)</p><p>Q = I × t</p><p>ne⁻ = Q/F</p><p>ne⁻ = (I × t)/F </p><p>dimana :</p><p>w = massa zat (g)</p><p>Q = muatan listrik (C)</p><p>I = kuat arus (A)</p><p>t = waktu (s)</p><p>F = tetapan Faraday (1 F = 96.500 C/mol)</p><p>n = jumlah elektron yang terlibat/perubahan biloks</p><p>ne⁻ = jumlah elektron (mol)</p><p> </p><p>Reaksi elektrolisis penyepuhan Zn oleh Ni dalam larutan NiCl<sub>2</sub> sebagai berikut.</p><p>NiCl<sub>2</sub>(aq) → Ni<sup>2</sup>⁺(aq) + 2Cl⁻(aq)</p><p>Pada katoda Ni akan mengendap.</p><p>Pada anoda terjadi pelarutan Ni.</p><p>Katoda (-) : Ni<sup>2</sup>⁺(<i>aq</i>) + 2e⁻ → Ni(<i>s</i>) </p><p>Anoda (+) : Ni(<i>s</i>) → Ni<sup>2</sup>⁺(<i>aq</i>) + 2e⁻</p><p>___________________________ <strong>+</strong></p><p>Ni(<i>s</i>)<sub>Anoda</sub> → Ni(<i>s</i>) <sub>Katoda</sub></p><p> </p><p>Data yang diketahui:</p><p>n = 2</p><p>t = 10 menit × 60 s/menit = 600 s</p><p>I = 9, 65 A </p><p>sehingga massa logam Ni yang mengendap adalah:</p><p>w<sub>Ni</sub> = (Ar/n) × (Q/F)</p><p>w<sub>Ni</sub> = (59 ÷ 2) × ((9,65 × 600) ÷ 96500)</p><p>w<sub>Ni</sub> = 1,77 g</p><p> </p><p><strong>Dengan demikian, massa logam nikel (Ni) yang mengendap adalah 1,77 gram.</strong></p>
Jawaban yang benar adalah B.
Pada penyepuhan sendok yang terbuat dari seng dan disepuh oleh nikel, maka yang akan mengalami elektrolisis adalah nikel (Ni).
Untuk menentukan massa logam yang mengendap yaitu logam Ni maka kita bisa menggunakan rumus hukum Faraday I.
Hukum Faraday I menyatakan bahwa "jumlah zat yang diendapkan pada elektrolisis sebanding dengan jumlah arus yang dilewatkan".
w = (Ar/n) × (Q/F)
Q = I × t
ne⁻ = Q/F
ne⁻ = (I × t)/F
dimana :
w = massa zat (g)
Q = muatan listrik (C)
I = kuat arus (A)
t = waktu (s)
F = tetapan Faraday (1 F = 96.500 C/mol)
n = jumlah elektron yang terlibat/perubahan biloks
ne⁻ = jumlah elektron (mol)
Reaksi elektrolisis penyepuhan Zn oleh Ni dalam larutan NiCl2 sebagai berikut.
NiCl2(aq) → Ni2⁺(aq) + 2Cl⁻(aq)
Pada katoda Ni akan mengendap.
Pada anoda terjadi pelarutan Ni.
Katoda (-) : Ni2⁺(aq) + 2e⁻ → Ni(s)
Anoda (+) : Ni(s) → Ni2⁺(aq) + 2e⁻
___________________________ +
Ni(s)Anoda → Ni(s) Katoda
Data yang diketahui:
n = 2
t = 10 menit × 60 s/menit = 600 s
I = 9, 65 A
sehingga massa logam Ni yang mengendap adalah:
wNi = (Ar/n) × (Q/F)
wNi = (59 ÷ 2) × ((9,65 × 600) ÷ 96500)
wNi = 1,77 g
Dengan demikian, massa logam nikel (Ni) yang mengendap adalah 1,77 gram.
· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



