Ana A
27 Januari 2023 02:03
Iklan
Ana A
27 Januari 2023 02:03
Pertanyaan
sebanyak 80 mL asam lemah, HA 0,2M yang mempunyai Ka = 10-5 ditambahkan ke dalam 20ml larutan NaOH 0,2 M. pH campuran yang terjadi adalah ... a. 3 - log 5 b. 4 - log 3 c. 5 - log 3 d. 8 + log 5
1
1
Iklan
D. Lestari,
Mahasiswa/Alumni Universitas Islam Negeri Maulana Malik Ibrahim Malang
29 Agustus 2023 20:33
<p>Jawaban yang benar adalah a. 3 - log 5</p><p> </p><p>Pembahasan</p><p>pH (power Hydrogen) merupakan derajat keasaman. Derajat keasaman ditentukan oleh besarnya konsentrasi ion hidrogen yang ada dalam larutan</p><p>dengan rumus</p><p>pH = -log [H<sup>+</sup>]</p><p> </p><p>Untuk menentukan pH campuran asam dengan basa, terlebih dahulu membuat reaksi mrs. Sebelumnya tentukan mol masing-masing larutan asam dan basa dengan rumus</p><p>mol = M x V</p><p> </p><p>asam lemah HA</p><p>mol = 0,2 M x 80 ml</p><p> = 16 mmol</p><p> </p><p>basa kuat NaOH</p><p>mol = 0,2 M x 20 ml</p><p> = 4 mmol</p><p> </p><p>Reaksi mrs dapat dilihat pada lampiran</p><p> </p><p>Persamaan reaksi menunjukkan sisa asam lemah, maka campuran asam basa ini merupakan larutan penyangga asam.</p><p>Mempunyai rumus </p><p>[H+] = Ka x (mol asam lemah/mol garam)</p><p> = 10<sup>-5</sup> x (12 mmol / 4 mmol)</p><p> = 10<sup>-5</sup> x 3</p><p>pH = -log [H<sup>+</sup>]</p><p> = 10<sup>-5</sup> x 3</p><p> = 3 - log 5</p><p> </p><p>Maka pH campuran yang terjadi adalah a. 3 - log 5</p>
Jawaban yang benar adalah a. 3 - log 5
Pembahasan
pH (power Hydrogen) merupakan derajat keasaman. Derajat keasaman ditentukan oleh besarnya konsentrasi ion hidrogen yang ada dalam larutan
dengan rumus
pH = -log [H+]
Untuk menentukan pH campuran asam dengan basa, terlebih dahulu membuat reaksi mrs. Sebelumnya tentukan mol masing-masing larutan asam dan basa dengan rumus
mol = M x V
asam lemah HA
mol = 0,2 M x 80 ml
= 16 mmol
basa kuat NaOH
mol = 0,2 M x 20 ml
= 4 mmol
Reaksi mrs dapat dilihat pada lampiran
Persamaan reaksi menunjukkan sisa asam lemah, maka campuran asam basa ini merupakan larutan penyangga asam.
Mempunyai rumus
[H+] = Ka x (mol asam lemah/mol garam)
= 10-5 x (12 mmol / 4 mmol)
= 10-5 x 3
pH = -log [H+]
= 10-5 x 3
= 3 - log 5
Maka pH campuran yang terjadi adalah a. 3 - log 5
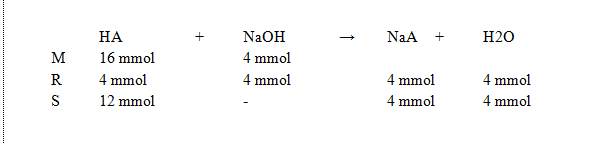
· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



