SM
Salsa M
23 Maret 2020 05:45
Iklan
SM
Salsa M
23 Maret 2020 05:45
Pertanyaan
Sebanyak 600 mL larutan CH3COOH 0,1 M dicampur dengan 600 mL CH3COONa 0,15 M (KaCH3COOH=1,8 x 10 min 5).Tentukan pH campuran tersebut
1
1
Iklan
DA
D. Aprilia
Mahasiswa/Alumni Universitas Pendidikan Indonesia
26 Desember 2021 08:07
Jawaban terverifikasi
Halo, Salsa :) Jadi, pH campuran tersebut adalah 5 - log1,2. Agar lebih paham, yuk simak penjelasan berikut ini. Larutan tersebut membentuk sistem penyangga yang bersifat asam. CH3COOH berperan sebagai asam, dan CH3COONa merupakan garam. Dari garam tersebut kita bisa mengetahui basa konjugasi beserta mol nya. Mol CH3COOH = M CH3COOH x V CH3COOH = 0,1 M x 600 mL = 60 mmol Mol CH3COONa = M CH3COONa x V CH3COONa = 0,15 M x600 mL = 90 mmol CH3COONa → CH3COO- + Na+ basa konjugasinya adalah ion CH3COO- , karena perbandingan koefisien basa konjugasi sama dengan garam nya, maka mol CH3COONa = mol CH3COO- = 90 mmol. Untuk menentukan pH campuran tersebut perhatikan gambar dibawah :
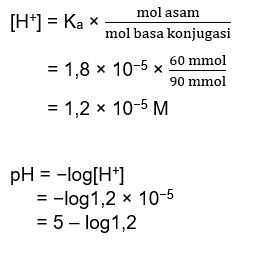
· 5.0 (1)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



