Andi M
13 Januari 2023 15:11
Iklan
Andi M
13 Januari 2023 15:11
Pertanyaan
Sebanyak 50mL larutan HCl 0,1M direaksikan dengan 20 mL larutan NaOH 0,1M. pH larutan tersebut adalah...
1
1
Iklan
Y. Frando
09 Februari 2023 03:18
<p>Jawaban yang benar adalah 1,4.</p><p> </p><p>Diketahui:</p><p>Pencampuran dua larutan</p><p>50 mL HCl 0,1 M dan 20 mL NaOH 0,1 M</p><p> </p><p>Ditanya:</p><p>pH larutan = ...?</p><p> </p><p>Jawab:</p><p>pH (Power of Hydrogen) merupakan derajat keasaman yang digunakan untuk menyatakan tingkat keasaman atau kebasaan yang dimiliki oleh suatu larutan. Tingkat keasaman berbanding terbalik dengan nilai pH, dimana semakin besar tingkat keasaman maka nilai pH semakin nilai kecil begitu pula sebaliknya. Pada skala pH, larutan dikatakan asam apabila memiliki nilai pH < 7 dan bersifat basa jika pH > 7. Jika pH = 7 maka larutan bersifat netral.</p><p> </p><p>Berdasarkan soal, dibuat terlebih dahulu tabel mula-mula, bereaksi, dan sisa seperti tampak pada gambar di bawah.</p><p>Dari sisa reaksi, terdapat HCl berlebih, ini artinya larutan akhir bersifat asam. Maka, hitung nilai Ma nya terlebih dahulu.</p><p> </p><p>Ma = n/V</p><p>Ma = 3/(50+20)</p><p>Ma = 3/70 M.</p><p> </p><p>Selanjutnya hitung nilai [H<sup>+</sup>], valensi asam HCl adalah 1, maka:</p><p>[H<sup>+</sup>] = n x [Ma]</p><p>[H<sup>+</sup>] = 1 x (3/70)</p><p>[H<sup>+</sup>] = 0,04</p><p>[H<sup>+</sup>] = 4 x 10^-2 M.</p><p> </p><p>Sehingga nilai pH nya adalah:</p><p>pH = - log [H<sup>+</sup>]</p><p>pH = - log (4 x 10^-2)</p><p>pH = 2 - log 4</p><p>pH = 1,4.</p><p> </p><p>Jadi, pH larutan tersebut adalah 1,4.</p>
Jawaban yang benar adalah 1,4.
Diketahui:
Pencampuran dua larutan
50 mL HCl 0,1 M dan 20 mL NaOH 0,1 M
Ditanya:
pH larutan = ...?
Jawab:
pH (Power of Hydrogen) merupakan derajat keasaman yang digunakan untuk menyatakan tingkat keasaman atau kebasaan yang dimiliki oleh suatu larutan. Tingkat keasaman berbanding terbalik dengan nilai pH, dimana semakin besar tingkat keasaman maka nilai pH semakin nilai kecil begitu pula sebaliknya. Pada skala pH, larutan dikatakan asam apabila memiliki nilai pH < 7 dan bersifat basa jika pH > 7. Jika pH = 7 maka larutan bersifat netral.
Berdasarkan soal, dibuat terlebih dahulu tabel mula-mula, bereaksi, dan sisa seperti tampak pada gambar di bawah.
Dari sisa reaksi, terdapat HCl berlebih, ini artinya larutan akhir bersifat asam. Maka, hitung nilai Ma nya terlebih dahulu.
Ma = n/V
Ma = 3/(50+20)
Ma = 3/70 M.
Selanjutnya hitung nilai [H+], valensi asam HCl adalah 1, maka:
[H+] = n x [Ma]
[H+] = 1 x (3/70)
[H+] = 0,04
[H+] = 4 x 10^-2 M.
Sehingga nilai pH nya adalah:
pH = - log [H+]
pH = - log (4 x 10^-2)
pH = 2 - log 4
pH = 1,4.
Jadi, pH larutan tersebut adalah 1,4.
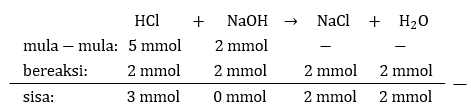
· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



