AN
Ainunnisa N
06 Maret 2022 06:51
Iklan
AN
Ainunnisa N
06 Maret 2022 06:51
Pertanyaan
Sebanyak 250 mL larutan NH4OH (Kb=1×10^-5) 0,1 M ditambah 250 mL larutan HCl 0,05 M. Tentukan pH larutan yg terbentuk!
5
1
Iklan
DA
D. Aprilia
Mahasiswa/Alumni Universitas Pendidikan Indonesia
10 Maret 2022 15:50
Jawaban terverifikasi
Hai Ainunnisa :) Jadi, pH larutan tersebut adalah 9. Simak perhitungannya dibawah ini yaa. Pada soal diketahui : V NH4OH = 250 mL M NH4OH = 0,1 M maka mol nya = M × V mol NH4OH = 0,1 M × 250 mL mol NH4OH = 25 mmol Kb NH4OH = 1×10¯⁵ V HCl = 250 mL M HCl = 0,05 M maka mol nya = 0,05 M × 250 mL mol HCl = 12,5 mmol Reaksi antara kedua senyawa tersebut dapat dilihat pada gambar yang terlampir. Pada persamaan reaksi, terdapat sisa 12,5 mmol NH4OH (basa lemah). Oleh karena itu, untuk menghitung pH campurannya kita gunakan rumus penyangga basa : [OH¯] = Kb × mol basa / mol asam konjugasi pOH = –log[OH¯] pH = 14 – pOH asam konjugasi dapat kita ketahui dari ionisasi garamnya (NH4Cl). NH4Cl → NH4+ + Cl¯ ion NH4+ merupakan asam konjugasinya. Untuk mol asam konjugasi tersebut akan sama dengan mol garam NH4Cl karena memiliki perbandingan koefisien yang sama. mol NH4Cl = mol NH4+ = 12,5 mmol [OH¯] = 1 × 10¯⁵ × 12,5 mmol / 12,5 mmol [OH¯] = 1 × 10¯⁵ pOH = –log[OH¯] pOH = –log1 × 10¯⁵ pOH = 5 pH = 14 – pOH pH = 14 – 5 = 9
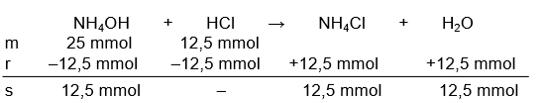
· 5.0 (7)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



