SS
Santika S
13 Februari 2022 23:50
Iklan
SS
Santika S
13 Februari 2022 23:50
Pertanyaan
Sebanyak 1,6 mol gas HI dipanaskan dalam ruang 2 liter pada 458°C sehingga sebagian terurai dan membentuk kesetimbangan: 2HI(g) -> H2(g) + I2(g) Apabila pada keadaan setimbang terdapat 0,4 mol H2 dan tekanan total gas sebesar 10 atm tentukalah harga Kp..
1
2
Iklan
IA
I. Azalia
27 Februari 2022 03:21
Jawaban terverifikasi
Halo Santika, saya bantu jawab ya. Harga Kp adalah 0,25. Kp merupakan tetakan kesetimbangan berdasarkan tekanan parsial. Konstanta/tekapan kesetimbangan tekanan (Kp) adalah perbandingan tekanan parsial produk dan tekanan parsial reaktan dipangkatkan koefisien masing-masing pada suatu reaksi kesetimbangan. Reaksi: 2HI(g) -> H2(g) + I2(g) Kp = (PH2)(PI2)/(PHI)^2 Menentukan mol gas pada saat setimbang, dapat dilihat pada persamaan reaksi MRS dibawah ini. H2 = 0,4 mol I2 = H2 = 0,4 mol mol HI = 0,8 mol Menentukan tekanan parsial masing-masing gas P total = 10 atm mol total = ( 0,4 + 0,4 + 0,8 ) mol = 1,6 mol PH2 = (mol H2/mol total) x P total PH2 = (0,4 mol/1,6 mol) x 1,6 mol = 0,4 atm PI2 = PH2 = 0,4 atm PHI = 2 x PH2 = 2 x 0,4 atm = 0,8 atm Menentukan harga Kp Kp = (PH2)(PI2)/(PHI)^2 Kp = (0,4)(0,4)/(0,8)^2 Kp = 1,6 x 10^-1/6,4 x 10^-1 Kp = 0,25 Terimakasih sudah bertanya, semoga membantu ^_^
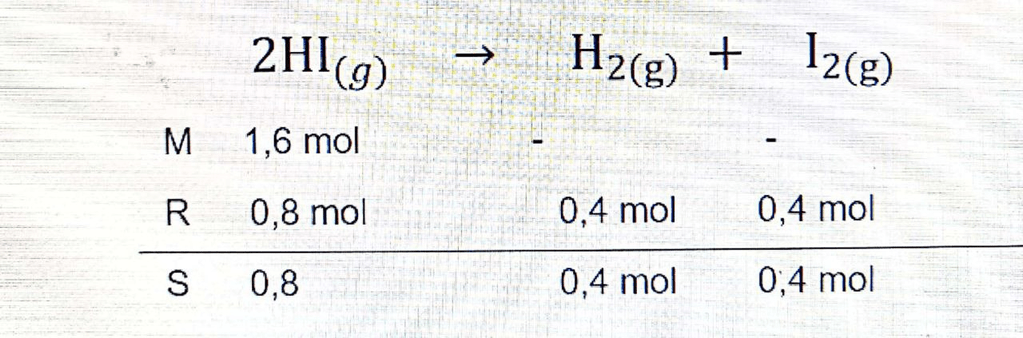
· 0.0 (0)
Iklan
IA
I. Azalia
Mahasiswa/Alumni Universitas Negeri Semarang
19 Februari 2022 14:17
Halo Santika, saya bantu jawab ya. Harga Kp adalah 0,25. Kp merupakan tetakan kesetimbangan berdasarkan tekanan parsial. Konstanta/tekapan kesetimbangan tekanan (Kp) adalah perbandingan tekanan parsial produk dan tekanan parsial reaktan dipangkatkan koefisien masing-masing pada suatu reaksi kesetimbangan. Reaksi: 2HI(g) -> H2(g) + I2(g) Kp = (PH2)(PI2)/(PHI)^2 Menentukan mol gas pada saat setimbang H2 = 0,4 mol I2 = H2 = 0,4 mol mol HI = (koef. HI/Koef. H2) x mol H2 mol HI = (2/1) x 0,4 mol mol HI = 0,8 mol Menentukan tekanan parsial masing-masing gas P total = 10 atm mol total = ( 0,4 + 0,4 + 0,8 ) mol = 1,6 mol PH2 = (mol H2/mol total) x P total PH2 = (0,4 mol/1,6 mol) x 1,6 mol = 0,4 atm PI2 = PH2 = 0,4 atm PHI = 2 x PH2 = 2 x 0,4 atm = 0,8 atm Menentukan harga Kp Kp = (PH2)(PI2)/(PHI)^2 Kp = (0,4)(0,4)/(0,8)^2 Kp = 1,6 x 10^-1/6,4 x 10^-1 Kp = 0,25 Terimakasih sudah bertanya, semoga membantu ^_^
· 0.0 (0)
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



