Olivia D
11 Oktober 2023 04:24
Iklan
Olivia D
11 Oktober 2023 04:24
Pertanyaan
pH larutan buffer 4 − log 2 terbuat dari campuran 500 mL CH₃COOH 0,1 M dan 200 mL NaOH 0,1 M. Hitung pH larutan jika ke dalam larutan ini ditambahkan 100 mL Ca(OH)₂ 0,15 M!
5
1
Iklan
J. Siregar
30 November 2023 19:11
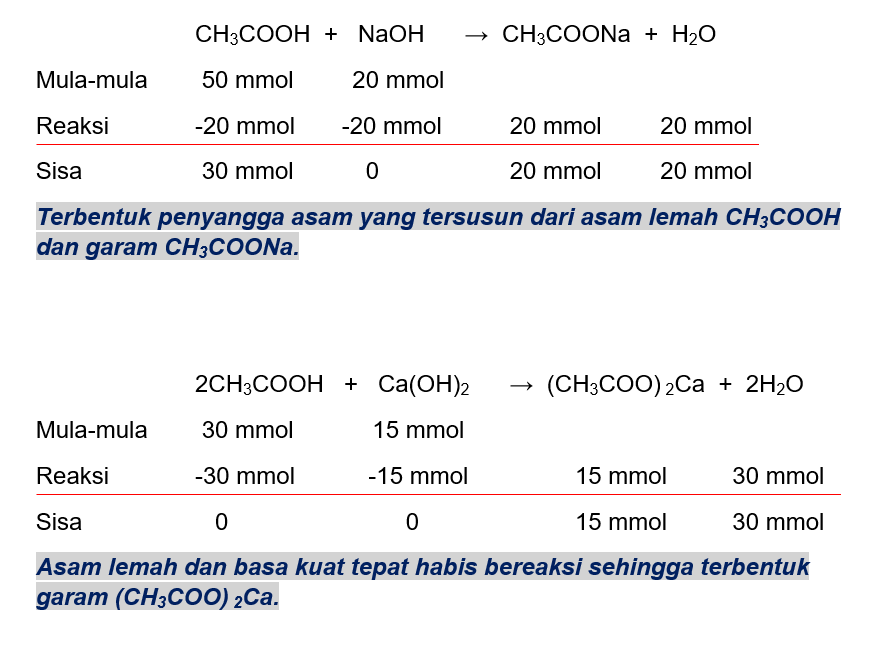
<p>Jawaban yang benar adalah 7 + log 1,7. </p><p> </p><p>Campuran CH<sub>3</sub>COOH - NaOH dapat membentuk larutan penyangga asam dengan syarat CH<sub>3</sub>COOH bersisa. Jika kedalam larutan penyangga tersebut ditambah sejumlah basa kuat maka komponen basa kuat akan bereaksi dengan asam lemah kembali. </p><p> </p><p>1) Hitung jumlah mol. </p><p>nCH<sub>3</sub>COOH = M.V = 0,1 M × 500 mL = 50 mmol </p><p>nNaOH = M.V = 0,1 M × 200 mL = 20 mmol </p><p>** CH<sub>3</sub>COOH bersisa 30 mmol dan terbentuk 20 mmol garam CH3COONa. (Tabel MRS nya terlampir) </p><p> </p><p>2) Hitung harga Ka. </p><p>[H+] = Ka. (mol asam lemah/mol basa konjugasi × valensi) </p><p>2.10<sup>-</sup>⁴ = Ka × (30/20) </p><p>Ka = 2(2.10<sup>-</sup>⁴) ÷ 3 </p><p>Ka = 1,3.10<sup>-</sup>⁴ </p><p> </p><p>3) Hitung pH campuran ketika ditambah Ca(OH)<sub>2</sub>. </p><p>nCa(OH)2 = M.V = 0,15 M × 100 mL = 15 mmol </p><p>Ca(OH)<sub>2</sub> akan bereaksi dengan komponen asam, CH<sub>3</sub>COOH. </p><p>Dari tabel MRS asam dan basa tepat habis beraksi sehingga pH campuran ditentukan dari pH garam yang terbentuk.</p><p>[(CH<sub>3</sub>COO)<sub>2</sub>Ca] = 15 mmol ÷ (500 + 200 + 100) mL = 1,875 × 10<sup>-4</sup> M</p><p>Valensi garam = 2</p><p>Garam bersifat basa.</p><p>[OH<sup>-</sup>] = √(Kw × [Garam] × valensi/Ka)</p><p>= √(10<sup>-14 </sup>× 0,0001875 × 2/1,3 × 10<sup>-</sup>⁴)</p><p>= √(3,75 × 10<sup>-18 </sup>÷ 1,3 × 10<sup>-</sup>⁴)</p><p>= √2,88 × 10<sup>-14</sup></p><p>= 1,7 × 10<sup>-7</sup> M</p><p>pOH = -log (1,7 × 10<sup>-7</sup>)</p><p>= 7 - log 1,7</p><p>pH = 14 - (7 - log 1,7)</p><p>= 7 + log 1,7</p><p> </p><p>Jadi, pH campuran sebesar 7 + log 1,7.</p>
Jawaban yang benar adalah 7 + log 1,7.
Campuran CH3COOH - NaOH dapat membentuk larutan penyangga asam dengan syarat CH3COOH bersisa. Jika kedalam larutan penyangga tersebut ditambah sejumlah basa kuat maka komponen basa kuat akan bereaksi dengan asam lemah kembali.
1) Hitung jumlah mol.
nCH3COOH = M.V = 0,1 M × 500 mL = 50 mmol
nNaOH = M.V = 0,1 M × 200 mL = 20 mmol
** CH3COOH bersisa 30 mmol dan terbentuk 20 mmol garam CH3COONa. (Tabel MRS nya terlampir)
2) Hitung harga Ka.
[H+] = Ka. (mol asam lemah/mol basa konjugasi × valensi)
2.10-⁴ = Ka × (30/20)
Ka = 2(2.10-⁴) ÷ 3
Ka = 1,3.10-⁴
3) Hitung pH campuran ketika ditambah Ca(OH)2.
nCa(OH)2 = M.V = 0,15 M × 100 mL = 15 mmol
Ca(OH)2 akan bereaksi dengan komponen asam, CH3COOH.
Dari tabel MRS asam dan basa tepat habis beraksi sehingga pH campuran ditentukan dari pH garam yang terbentuk.
[(CH3COO)2Ca] = 15 mmol ÷ (500 + 200 + 100) mL = 1,875 × 10-4 M
Valensi garam = 2
Garam bersifat basa.
[OH-] = √(Kw × [Garam] × valensi/Ka)
= √(10-14 × 0,0001875 × 2/1,3 × 10-⁴)
= √(3,75 × 10-18 ÷ 1,3 × 10-⁴)
= √2,88 × 10-14
= 1,7 × 10-7 M
pOH = -log (1,7 × 10-7)
= 7 - log 1,7
pH = 14 - (7 - log 1,7)
= 7 + log 1,7
Jadi, pH campuran sebesar 7 + log 1,7.
· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke Forum
Biar Robosquad lain yang jawab soal kamu

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



