Faisal B
22 Agustus 2022 23:45
Iklan
Faisal B
22 Agustus 2022 23:45
Pertanyaan
Perhatikan struktur molekul berikut! Bentuk molekul di sekitar atom N yang mengikat dua atom H adalah .... (A) linier. (B) bentuk V. (C) bentuk T. (D) segitiga planar. (E) piramida segitiga.
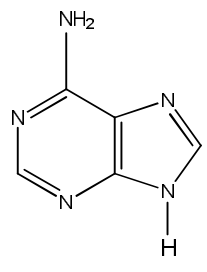
1
1
Iklan
A. Yanti
12 Oktober 2022 00:05
<p>Jawabannya adalah E.</p><p> </p><p>Dasar penyelesaian soal ini adalah menentukan elektron valensi masing-masing. Jika dilihat pada sistem periodik unsur, atom N menempati golongan VA, sedangkan H menempati golongan IA.</p><p> </p><p>Konfigurasi elektron N dan H dapat dilihat seperti di bawah ini : </p><p><sub>7</sub>N : 1s<sup>2</sup> 2s<sup>2</sup> 2p<sup>3 </sup></p><p>elektron valensinya adalah 2s<sup>2</sup> 2p<sup>3 </sup>= 5</p><p> </p><p><sub>1</sub>H : 1s<sup>1</sup> <sup> </sup></p><p>elektron valensinya adalah 1s<sup>1 </sup>= 1</p><p> </p><p>Penentuan tipe molekul mengikuti kaidah sebagai berikut :</p><p>AXnEm </p><p>Keterangan:</p><p>A = atom pusat </p><p>X = pasangan elektron ikatan (PEI) </p><p>n = jumlah PEI </p><p>E = pasangan elektron bebas (PEB) </p><p>m = jumlah PEB </p><p> </p><p>PEB dapat ditentukan dengan rumus PEB = (EV atom pusat – X)/2 </p><p> </p><p>Atom N yang mengikat 2 atom H dan 1 ikatan gugus lain merupakan atom pusat, yang berarti menunjukan sebenarnya ada 3 elektron dari N yang mengikat 2 elektron dari 2 atom H dan 1 gugus lainnya, sehingga PEI = 3 atau dapat ditulis sebagai AX3. </p><p> </p><p>Oleh karena itu, PEB dari -NH<sub>2</sub> ditentukan sebagai berikut :</p><p> </p><p>PEB = (5-3)/2 </p><p>PEB = 1 </p><p> </p><p>Atau bisa ditulis sebagai E1 </p><p> </p><p>Berdasarkan pembahasan di atas bahwa -NH<sub>2 </sub>memiliki PEI = 3 dan PEB = 1 sehingga tipe molekulnya adalah AX3E1 dengan bentuknya adalah piramida trigonal atau piramida segitiga (silahkan cocokan dengan data pada tabel).</p><p> </p><p>Jadi, jawabannya adalah bentuk molekul N yang mengikat 2 atom H adalah piramida segitiga.</p>
Jawabannya adalah E.
Dasar penyelesaian soal ini adalah menentukan elektron valensi masing-masing. Jika dilihat pada sistem periodik unsur, atom N menempati golongan VA, sedangkan H menempati golongan IA.
Konfigurasi elektron N dan H dapat dilihat seperti di bawah ini :
7N : 1s2 2s2 2p3
elektron valensinya adalah 2s2 2p3 = 5
1H : 1s1
elektron valensinya adalah 1s1 = 1
Penentuan tipe molekul mengikuti kaidah sebagai berikut :
AXnEm
Keterangan:
A = atom pusat
X = pasangan elektron ikatan (PEI)
n = jumlah PEI
E = pasangan elektron bebas (PEB)
m = jumlah PEB
PEB dapat ditentukan dengan rumus PEB = (EV atom pusat – X)/2
Atom N yang mengikat 2 atom H dan 1 ikatan gugus lain merupakan atom pusat, yang berarti menunjukan sebenarnya ada 3 elektron dari N yang mengikat 2 elektron dari 2 atom H dan 1 gugus lainnya, sehingga PEI = 3 atau dapat ditulis sebagai AX3.
Oleh karena itu, PEB dari -NH2 ditentukan sebagai berikut :
PEB = (5-3)/2
PEB = 1
Atau bisa ditulis sebagai E1
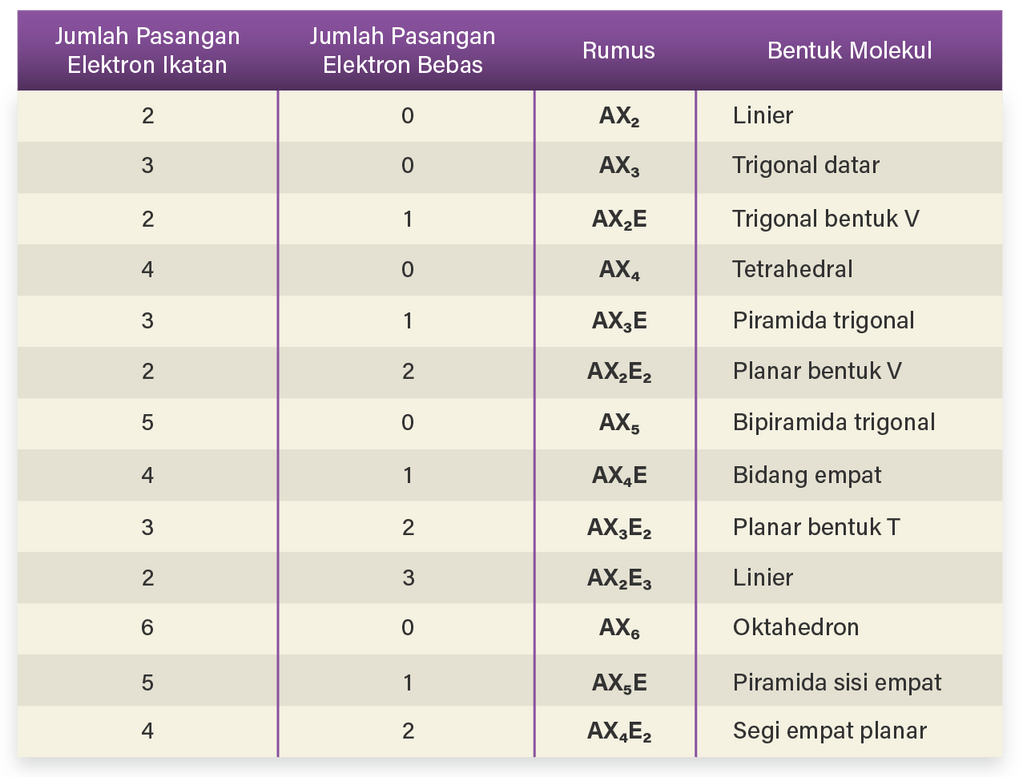
Berdasarkan pembahasan di atas bahwa -NH2 memiliki PEI = 3 dan PEB = 1 sehingga tipe molekulnya adalah AX3E1 dengan bentuknya adalah piramida trigonal atau piramida segitiga (silahkan cocokan dengan data pada tabel).
Jadi, jawabannya adalah bentuk molekul N yang mengikat 2 atom H adalah piramida segitiga.
· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke Forum
Biar Robosquad lain yang jawab soal kamu

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



