IN
Icha N
16 Mei 2022 15:22
Iklan
IN
Icha N
16 Mei 2022 15:22
Pertanyaan
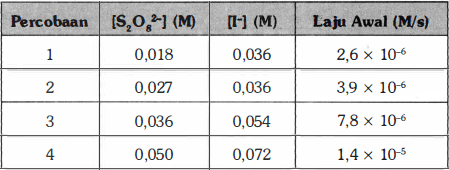
Perhatikan reaksi ion peroksidisulfat (S2O8^2-) dengan ion iodida (I^-) dalam suatu larutan sesuai dengan persamaan kimia berikut: S2O8^2-(aq) + 3I^-(aq) → 2SO4^2-(aq) + I3^-(aq) Pada suhu tertentu laju awal pengurangan S2O8^2- bervariasi tergantung dari konsentrasi pereaksi seperti ditunjukkan pada tabel berikut: (b) Berapakah nilai rata-rata tetapan laju untuk reaksi pengurangan S2O8^2- berdasarkan keempat data pada tabel di atas?
8
1
Iklan
YA
Y. Ayu
17 Mei 2022 12:25
Jawaban terverifikasi
Jawaban: k = 3,981 x 10^-3 Tetapan laju reaksi (k) merupakan tetapan yang nilainya bergantung berdasarkan kondisi reaksi. Untuk menentukan tetapan laju reaksi, perlu diketahui dahulu orde reaksinya. Orde reaksi itu merupakan pangkat molaritas dalam persamaan laju reaksi. Orde reaksi diperoleh dari percobaan dengan mencari salah satu orde dari reaktan ketika konsentrasi reaktan lain dibuat tetap. Rumus laju reaksi adalah: r = k [A]^x [B]^y r = laju reaksi (M/s) k = tetapan laju reaksi [A] dan [B]= konsentrasi zat (M) x dan y = orde reaksi Untuk menentukan orde reaksi terhadap S2O8^2- dapat menggunakan data dengan konsentrasi I- yang dibuat tetap (data 1 dan 2). r1 = k [S2O8^2-]^x [I-]^y 2,6 x 10^-6 M/s = k (0,018 M)^x (0,036 M)^y r2 = k [S2O8^2-]^x [I-]^y 3,9 x 10^-6 M/s = k (0,027 M)^x (0,036 M)^y Jika kedua persamaan laju dibandingkan, maka didapatkan: r1/r2 = (k [S2O8^2-]^x [I-]^y)/(k [S2O8^2-]^x [I-]^y) (2,6 x 10^-6 M/s)/(3,9 x 10^-6 M/s) = (k (0,018 M)^x (0,036 M)^y)/(k (0,027 M)^x (0,036 M)^y) 2/3 = (0,018 M)^x/(0,027 M)^x 2/3 = (2/3)^x x = 1 Untuk menentukan orde reaksi terhadap I- dapat menggunakan data dengan konsentrasi S2O8^2- dan orde reaksi yang telah dihitung. r1 = k [S2O8^2-] [I-]^y 2,6 x 10^-6 M/s = k (0,018 M) (0,036 M)^y r3 = k [S2O8^2-] [I-]^y 7,8 x 10^-6 M/s = k (0,036 M) (0,054 M)^y Jika kedua persamaan laju dibandingkan, maka didapatkan: r1/r3 = (k [S2O8^2-] [I-]^y)/(k [S2O8^2-] [I-]^y) (2,6 x 10^-6 M/s)/(7,8 x 10^-6 M/s) = (k (0,018 M) (0,036 M)^y)/(k (0,036 M) (0,054 M)^y) 1/3 = 1/2 x (0,036 M)^y/(0,054 M)^y 2/3 = (2/3)^y y = 1 Maka, persamaan laju reaksinya adalah: r = k [S2O8^2-] [I-] Nilai tetapan laju reaksi pada masing-masing percobaan adalah: r = k [S2O8^2-] [I-] 1) 2,6 x 10^-6 M/s = k (0,018 M) (0,036 M) k = 4,012 x 10^-3 2) 3,9 x 10^-6 M/s = k (0,027 M) (0,036 M) k = 4,012 x 10^-3 3) 7,8 x 10^-6 M/s = k (0,036 M) (0,054 M) k = 4,012 x 10^-3 4) 1,4 x 10^-5 M/s = k (0,05 M) (0,072 M) k = 3,888 x 10^-3 Rata-rata tetapan laju reaksi adalah: k = (4,012 x 10^-3 + 4,012 x 10^-3 + 4,012 x 10^-3 + 3,888 x 10^-3)/4 k = 3,981 x 10^-3 Jadi, nilai rata-rata tetapan laju reaksi tersebut adalah 3,981 x 10^-3.
· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



