AA
Aziza A
03 Maret 2022 16:42
Iklan
AA
Aziza A
03 Maret 2022 16:42
Pertanyaan
Perhatikan penjelasan tentang baterai kering. Jelaskan kelebihan dan kelemahan sel kering jika dibandingkan dengan sel lainnya.
14
1
Iklan
FN
F. Nursanty
Mahasiswa/Alumni Universitas Diponegoro Semarang
23 Maret 2022 04:04
Jawaban terverifikasi
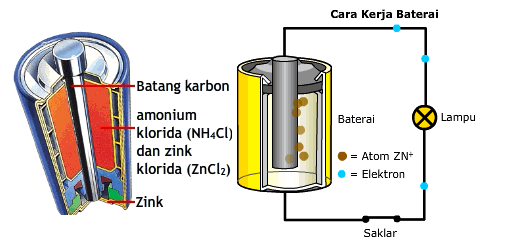
Hallo Aziza.. kakak bantu jawab ya.. Jawaban dari pertanyaanmu adalah.. Kelebihan: murah, mudah dibawa/ disimpan, dapat diperoleh/dibentuk dalam berbagai ukuran; Kekurangan: pada (pengeluaran) arus yang tinggi mengeluarkan air, membebaskan gas amoniak [NH3(g)], yang menyebabkan turunnya tegangan (voltage drop). Sel kering mempunyai waktu hidup relatif pendek karena anoda seng (Zn) bereaksi dengan ion NH4+(aq) yang bersifat asam, dan tidak dapat dimuati/diisi kembali (nonrechargeable). Adapun pembahasannya sebagai berikut : Pengertian baterai secara sederhana ialah alat yang melakukan reaksi kimia untuk dapat menghasilkan listrik. Baterai kering atau elemen kering pada dasarnya memiliki beberapa bagian seperti elektroda (dua zat penghantar listrik yang berbeda) dan elektrolit (cairan untuk menghantarkan listrik). Sel Kering: Zn – C (Seng – Karbon) Ditemukan 1860-an dengan nama sel kering, atau sel Leclanche dan lebih familiar dalam kehidupan sehari-hari sebagai baterai biasa. Baterai ini terdiri dari selongsong (wadah) seng (Zn) yang berfungsi sebagai anoda dari campuran MnO2 dan pasta elektrolit yang terdiri dari NH4Cl, ZnCl2, H2O, dan pati. Sedangkan katodanya adalah batang grafit (tidak aktif). Serbuk grafit ditambahkan untuk meningkatkan aliran (konduktivitas). Pada baterai ini anoda merupakan kutup positif Sel kering sebenarnya tidak sama sekali kering, disebut sel kering karena elektrolitnya berbentuk pasta (bukan cair). Reaksi di Anoda (Oksidasi):Zn(s) → Zn2+(aq) + 2e- Reaksi di Katoda (Reduksi): 2MnO2(s) +2NH4+(aq) +2e- →Mn2O3(s) +2NH3(aq) +H2O(l) Reaksi di katoda lebih kompleks dan kurang lengkap untuk dimengerti. MnO2(s) direduksi menjadi Mn2O3(s) melalui sederet tahapan yang melibatkan terbentuknya Mn2+ dan reaksi asam-basa antara NH4+ dan OH-. Amoniak yang dihasilkan selain menjadi gas, juga membentuk kompleks dengan Zn2+ dan membentuk kristal jika kontak dengan ion Cl-: Zn2+(aq) + 2NH3(aq) + Cl-(aq) → Zn(NH3)2Cl2(s) Reaksi keseluruhan dalam sel: 2MnO2(s)+2NH4Cl(aq)+Zn(s)→Zn(NH3)2Cl2(s)+H2O(l)+Mn2O3(s) Esel = 1,5 Volt Penggunaan: radio (jinjing, portable), lampu senter, mainan (anak-anak); Jadi kesimpulannya Kelebihan: murah, mudah dibawa/ disimpan, dapat diperoleh/dibentuk dalam berbagai ukuran; Kekurangan: pada (pengeluaran) arus yang tinggi mengeluarkan air, membebaskan gas amoniak [NH3(g)], yang menyebabkan turunnya tegangan (voltage drop). Sel kering mempunyai waktu hidup relatif pendek karena anoda seng (Zn) bereaksi dengan ion NH4+(aq) yang bersifat asam, dan tidak dapat dimuati/diisi kembali (nonrechargeable Semoga jawaban ini bisa membantu
· 5.0 (1)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



