Lewis L
13 Januari 2023 10:03
Iklan
Lewis L
13 Januari 2023 10:03
Pertanyaan
Perhatikan kedua gambar larutan berikut! Pernyataan yang benar mengenai kedua larutan diatas adalah.. a. [H+] kedua larutan sama b. Larutan HCOOH terionisasi lebih banyak c. Seluruh molekul NH4OH terionisasi dalam air d. Kedua larutan memiliki pH yang sama. e. Larutan NH4OH mengubah lakmus biru jadi merah
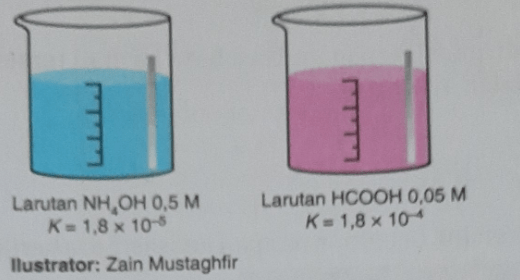
4
1
Iklan
J. Siregar
Mahasiswa/Alumni Universitas Negeri Medan
27 Maret 2023 12:25
<p><strong><u>Jawaban yang benar adalah B.</u></strong></p><p> </p><p>NH<sub>4</sub>OH merupakan senyawa basa lemah, sedangkan HCOOH termasuk asam lemah. Kedua larutan ini mengalami ionisasi sebagian di dalam air. </p><ul><li>NH<sub>4</sub>OH yang bersifat basa akan mengubah warna kertas lakmus merah menjadi biru.</li><li>HCOOH yang bersifat asam akan mengubah warna kertas lakmus biru menjadi merah.</li></ul><p> </p><p>Perhitungan pH kedua larutan sebagai berikut.</p><p><strong>Larutan NH<sub>4</sub>OH </strong></p><p>[OH<sup>-</sup>] = √Kb.M</p><p>[OH<sup>-</sup>] = √(1,8×10<sup>-5</sup>×0,5)</p><p>[OH<sup>-</sup>] = 3×10<sup>-3 </sup>M</p><p>pOH = -log [OH<sup>-</sup>]</p><p>pOH = -log (3×10<sup>-3</sup>)</p><p>pOH = 3 - log 3</p><p>pH = 14 - pOH</p><p>pH = 14 - (3 - log 3)</p><p>pH = 11 + log 3</p><p>Derajat ionisasi (α) NH<sub>4</sub>OH </p><p>α = [OH<sup>-</sup>]/M</p><p>α = 3×10<sup>-3</sup>/0,5</p><p>α = 0,006 × 100%</p><p>α = 0,6%</p><p> </p><p><strong>Larutan HCOOH </strong></p><p>[H<sup>+</sup>] = √Ka.M</p><p>[H<sup>+</sup>] = √(1,8×10<sup>-4</sup>×0,05)</p><p>[H<sup>+</sup>] = 3×10<sup>-3 </sup>M</p><p>pH = -log [H<sup>+</sup>]</p><p>pH = -log (3×10<sup>-3</sup>)</p><p>pH = 3 - log 3</p><p>Derajat ionisasi (α) HCOOH </p><p>α = [H<sup>+</sup>]/M</p><p>α = 3×10<sup>-3</sup>/0,05</p><p>α = 0,06 × 100%</p><p>α = 6%</p><p>Dari harga derajat ionisasi, dapat kita ketahui bahwa HCOOH lebih banyak terionisasi.</p><p> </p><p><strong>Dengan demikian, pernyataan yang benar adalah HCOOH terionisasi lebih banyak.</strong></p>
Jawaban yang benar adalah B.
NH4OH merupakan senyawa basa lemah, sedangkan HCOOH termasuk asam lemah. Kedua larutan ini mengalami ionisasi sebagian di dalam air.
- NH4OH yang bersifat basa akan mengubah warna kertas lakmus merah menjadi biru.
- HCOOH yang bersifat asam akan mengubah warna kertas lakmus biru menjadi merah.
Perhitungan pH kedua larutan sebagai berikut.
Larutan NH4OH
[OH-] = √Kb.M
[OH-] = √(1,8×10-5×0,5)
[OH-] = 3×10-3 M
pOH = -log [OH-]
pOH = -log (3×10-3)
pOH = 3 - log 3
pH = 14 - pOH
pH = 14 - (3 - log 3)
pH = 11 + log 3
Derajat ionisasi (α) NH4OH
α = [OH-]/M
α = 3×10-3/0,5
α = 0,006 × 100%
α = 0,6%
Larutan HCOOH
[H+] = √Ka.M
[H+] = √(1,8×10-4×0,05)
[H+] = 3×10-3 M
pH = -log [H+]
pH = -log (3×10-3)
pH = 3 - log 3
Derajat ionisasi (α) HCOOH
α = [H+]/M
α = 3×10-3/0,05
α = 0,06 × 100%
α = 6%
Dari harga derajat ionisasi, dapat kita ketahui bahwa HCOOH lebih banyak terionisasi.
Dengan demikian, pernyataan yang benar adalah HCOOH terionisasi lebih banyak.
· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



