AH
Ai H
13 Juni 2022 05:27
Iklan
AH
Ai H
13 Juni 2022 05:27
Pertanyaan
Perhatikan gambar percobaan berikut! Massa jenis larutan dianggap 1 g/mL dan kalor jenis larutan = 4,2 J/g°C. Perubahan entalpi (ΔH) untuk reaksi: HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l) per mol H2O yang terbentuk adalah ... (A) −504 kJ (B) −515 kJ (C) −546 kJ (D) −554 kJ (E) −571 kJ
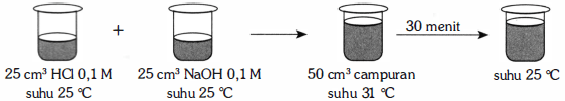
6
1
Iklan
GP
G. Pramiyanti
13 Juni 2022 08:17
Jawaban terverifikasi
Jawaban dari pertanyaan diatas adalah (A). -504 kJ. Pembahasan : Kalorimeter Q larutan = m x c x ∆T ∆H = - (Q/mo) Keterangan : m = massa larutan (gram) c = kalor jenis (J/gr.°C) ∆T = perubahan suhu (K atau °C) mol = jumlah mol pereaksi (mol) V HCl = 25 cm3= 25 ml M HCl = 0,1 M Jadi Mol HCl = M x V = 0,1 M x 25 ml = 2,5 mmol = 2,5 x 10-3 mol V NaOH = 25 cm3= 25 ml M NaOH = 0,1 M Jadi Mol NaOH = M x V = 0,1 M x 25 ml = 2,5 mmol = 2,5 x 10-3 mol Reaksi : HCl (aq) + NaOH (aq) --> NaCl (aq) + H2O (l) mol H2O = mol HCl = mol NaOH = 2,5 x 10^-3 mol * V larutan = V HCl + V NaOH = 25 ml + 25 ml = 50 ml * Massa jenis larutan = 1 gr/ml * m larutan = V larutan x massa jenis = 50 ml x 1 gr/ml = 50 gram * c = 4,2 J/gr.°C Q = m x c x ∆T Q = 50 gr x 4,2 K/gr.°C x 6 °C Q = 1.260 J = 1,26 kJ. ∆H = - (Q/mol) ∆H = -(1,26 kJ/ 2,5 x 10^-3) = -504 kJ Dengan demikian jawaban dari pertanyaan diatas adalah (A). -504 kJ.
· 1.5 (2)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



