Ichsanul F
15 Januari 2023 07:40
Iklan
Ichsanul F
15 Januari 2023 07:40
Pertanyaan
Perhatikan gambar berikut: Jika diketahui Kf air = 1,86°C/m dan Kb air = 0.52°C/m, maka titik didih NaCl 2 m adalah ...°C. A. 101,56 B. 102,08 C. 101,04 D. 100,52 E. 100,26
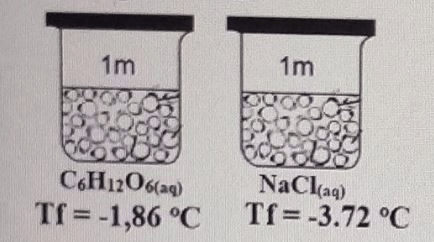
7
1
Iklan
J. Siregar
Mahasiswa/Alumni Universitas Negeri Medan
02 Februari 2023 05:25
<p><strong><u>Jawaban yang benar adalah B.</u></strong></p><p> </p><p>Kenaikan titik didih larutan merupakan selisih antara titik didih larutan dengan titik didih pelarut. Kenaikan titik didih (ΔTb) dapat dihitung berdasarkan rumus berikut. </p><p>ΔTb = Kb x m x i (larutan elektrolit)</p><p>Tb = ΔTb + Tb°</p><p>dimana:</p><p>ΔTb = kenaikan titik didih (℃)</p><p>Tb = titik didih larutan (℃)</p><p>Tb° = titik didih pelarut murni (℃)</p><p>m = konsentrasi larutan (molal)</p><p>i = faktor van't Hoff</p><p>i = 1 + (n-1)α</p><p> </p><p>NaCl merupakan larutan elektrolit kuat yang dapat terionisasi sempurna dalam air dengan nilai α = 1.</p><p>Reaksi ionisasi:</p><p>NaCl(aq) → Na⁺(aq) + Cl⁻(aq)</p><p>jumlah ion (n) = 2</p><p>• Hitung ΔTb.</p><p>ΔTb = Kb x m x i</p><p>ΔTb = 0,52 °C/m x 2 m x {1 + (2-1)1}</p><p>ΔTb = 2,08 °C</p><p>• Hitung Tb larutan NaCl.</p><p>Tb = ΔTb + Tb° (pelarut : air)</p><p>Tb = 2,08 °C + 100 °C</p><p>Tb = 102,08 °C</p><p> </p><p>Jadi, titik didih larutan NaCl sebesar 102,08 °C.</p>
Jawaban yang benar adalah B.
Kenaikan titik didih larutan merupakan selisih antara titik didih larutan dengan titik didih pelarut. Kenaikan titik didih (ΔTb) dapat dihitung berdasarkan rumus berikut.
ΔTb = Kb x m x i (larutan elektrolit)
Tb = ΔTb + Tb°
dimana:
ΔTb = kenaikan titik didih (℃)
Tb = titik didih larutan (℃)
Tb° = titik didih pelarut murni (℃)
m = konsentrasi larutan (molal)
i = faktor van't Hoff
i = 1 + (n-1)α
NaCl merupakan larutan elektrolit kuat yang dapat terionisasi sempurna dalam air dengan nilai α = 1.
Reaksi ionisasi:
NaCl(aq) → Na⁺(aq) + Cl⁻(aq)
jumlah ion (n) = 2
• Hitung ΔTb.
ΔTb = Kb x m x i
ΔTb = 0,52 °C/m x 2 m x {1 + (2-1)1}
ΔTb = 2,08 °C
• Hitung Tb larutan NaCl.
Tb = ΔTb + Tb° (pelarut : air)
Tb = 2,08 °C + 100 °C
Tb = 102,08 °C
Jadi, titik didih larutan NaCl sebesar 102,08 °C.
· 0.0 (0)
Iklan
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



